TLC(薄層クロマトグラフィー)のRf値で化合物を同定
TLC(薄層クロマトグラフィー)は化合物の極性の把握や分離・精製するために使われるクロマトグラフィーの一種です。 TLCの原理について学ぶ
TLCには
- 素早い化合物の分離が可能
- 化合物を目視で確認可能
という2つの利点があります。
そのため、反応後の混合物のTLCを測定すれば「どのような化合物が何個あるか?」を調べることができます。
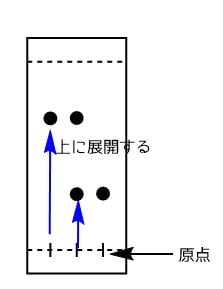
TLCの展開
TLCは化合物を一番下の原点から上に移動させます。
この時の移動距離を表すものがRf値に相当します。

Rf値は同じ条件でTLCを測定すればいつも同じになるので、Rf値を比較すれば目的の化合物ができたかどうかを知ることができます。
Rf値の計算方法
それではRf値の計算方法について説明します。
実際のRf値は移動距離ではなく、化合物が展開した距離と展開溶媒が移動した距離の比率です。
Rf = 化合物が展開した距離 / 展開溶媒が移動した距離
例えば下の図のようなTLCを測定したとしましょう。展開溶媒は下線から10 cmのところまで上がります。それに対して、化合物の展開距離は下線から7cmのところです。
この化合物のRf値は
Rf = 7 cm ÷ 10 cm = 0.7
となります。
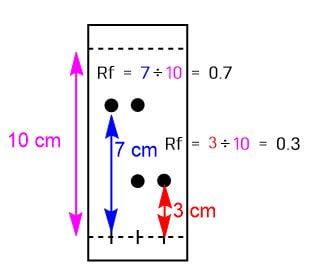
TLCのRf値の計算
Rf値 = (化合物が展開した距離)÷ (展開溶媒が移動した距離)
なぜRf値を算出するの?分かることとは?
Rf値を計算する理由は、人によって展開する距離が異なることがあるためです。
展開距離に対してどのくらいの位置に化合物が来るか?は決まっているためRf値を計算すれば同じ化合物かどうか比較できます。
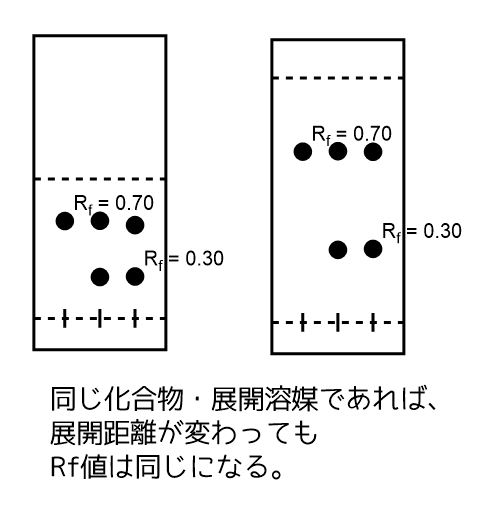
例えば、論文では「化合物A、ヘキサン:酢酸エチル=4:1、Rf=0.5」と書かれています。
同じ化合物が合成できたかどうか?は同じ展開溶媒で展開させたときのRf値を計算して比較することができます。
Rf値によって化合物の相対的な極性・官能基がわかる!
TLCのRf値では、
同じ条件で化合物のRf値を比較した時
- Rf値が1に近い時は極性が低い
- Rf値が0に近いほど極性が高い
という相対的な極性が分かります。なぜなら、極性の高い化合物ほど、TLCの表面に引っ付きやすく、極性の低い化合物ほどくっつきにくいからです。
TLCに吸着しにくいから、低極性の化合物は上に移動しやすくなります。だからRf値が高くなります。詳細
同じ条件の時にRf値が低いことは、その化合物中に極性官能基(NH2,COOH、OH等)があり、Rf値が高い時は、極性官能基が少ない分子であることがわかります。
さらに、発色試薬と組み合わせることによって、より正確に「どんな官能基が存在するか?」を調べることが可能です。(ニンヒドリンはアミンが含まれると紫色に変色する)
Rf値が高い = 極性が低い分子 = アルキル鎖やベンゼン環などCH化合物の割合が大きい
Rf値が低い = 極性が高い分子 = アルコール、カルボン酸、アミン等
基本的に展開溶媒が変化すればRf値は変わりますが、同じ条件で展開したときには同じ結果が得られます。
そして、展開溶媒の極性を下げればRf値が上がりにくくなり、極性を上げればRf値が上がりやすくなります。
Rf値を使った化合物の同定例
例えば、エステルをカルボン酸に加水分解する反応を行っていると仮定してみましょう!

この仮定では、原料であるエステルは持っていますが、カルボン酸は反応後の物質であるため持っていません。
ここで、反応が進行したかどうかをTLCで測定して考察してみます。これは三点打ちの手法を使います。下の図に概略を載せます。
三点打ちは、反応を行った後に、一番左側と真ん中に原料のエステルを打ち(スポッティングとも言います)、右側と真ん中には反応後の液体を打ちます。
真ん中は原料と反応液の両方を重ねて打ってあります。これを展開すると下図のようなTLCが得られてきました。(このように真ん中を重ねて打つ方法を重ね打ちと言います)
スポットが別の位置に出た場合
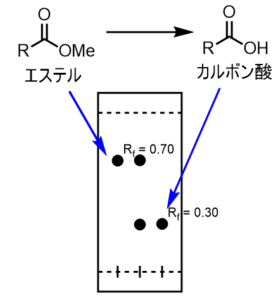
まず「左:原料」と「右:反応液」を比較しましょう。
カルボン酸は非常に高極性の分子であることから、エステルよりもRf値が高くなることが予想されます。
右側のスポットはRf値が0.3と予測通りであり、原料のRf値と0.5離れています。よって、予想外の反応が起きていなければ、目的のカルボン酸体が得られていると考えられます。
では以下のようなTLCが得られてきた場合はどうでしょうか
スポットが同じ位置に出た場合
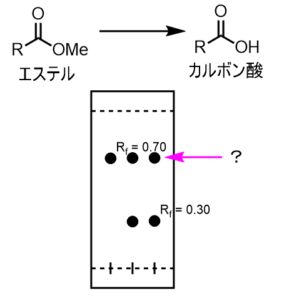
先程とは違って、一番右側の上にスポットが現れています。
これは何でしょうか?
Rf値を計算するとRf=0.7と原料と同じであることが分かります。したがってこの右の上のスポットは原料であることが予想されます。
より確実な予想をするために、真ん中のラインを見てみます。真ん中のラインでは、原料と反応液の両方を重ね打ちしています。もしも右側のスポットが原料であれば、ぴったり重なって一つのスポットにしか見えません。
右側のスポットが原料とは別の物質だった場合は、雪だるまやひょうたんのような2つの丸が見えるようになります。上のTLCではピッタリと重なっているため、原料である可能性が一段と高まりました。
では下のようなTLCだった場合はどうでしょうか?
スポットがほとんど同じ位置の場合
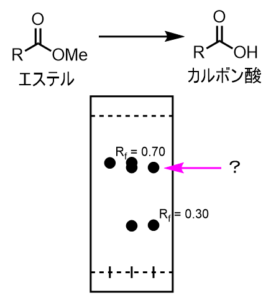
右側のスポットは先程とおなじようにRf=0.7位でしたが、真ん中で原料と重ねて打ったラインではピッタリと重ならずに2つのスポットがあるように見えます。つまり、上に現れたスポットはRf値は非常に近くても、原料ではない化合物である可能性が非常に高いということが分かります。
これはおそらく目的としているエステルの加水分解反応以外の副反応が起きてしまったと考えられます。
このように有機合成では
「反応の進行を調べるための簡便な手法」
として重宝されています。
Rf値は化合物同定に有用な情報の一つ
化合物のRf値は、展開溶媒によって変化しますが、展開溶媒が同じであれば大体同じ距離で展開されます。つまり、論文にTLCを展開した条件(ヘキサン:酢酸エチル=1:1)とRf値が書いてあれば、それと同じ条件でTLCを打つことによって、論文に載っていた化合物と同じかどうかが推測できます。
昔の論文ではTLCに関する情報が結構載っていて、例えばスミチオンという化合物では
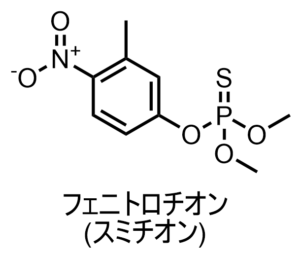
スミチオンのTLC情報
- (A) ヘキサン:アセトン = 4:1 → Rf = 0.57
- (B) ヘキサン:アセトン = 2:1 → Rf = 0.75
- (C) ヘキサン:アセトン = 1:1 → Rf = 0.83
- (D) ヘキサン:ジオキサン = 9:1 → Rf = 0.32
- (E) ヘキサン:メタノール = 9:1 → Rf = 0.55
などのように記載されていたりします。
Rf値は展開溶媒の組み合わせによっても大きく変化するので、たいていは一つ以上の溶媒の条件が載せることによって、確実性を上げています。(最近はTLC情報は載っていないことも多い)
Rf値から分子の極性がわかる
Rf値が高いときは、化合物の極性が低いことを表します(相対的なもので、展開溶媒によって変化する)。化合物の極性が低いというのは逆に、極性官能基が少ないことを意味します。
極性官能基はヘテロ原子を含むものが多いです。なかでもカルボン酸のようなイオン化しやすい官能基は極性が高い傾向があります。他にも水酸基、あるいはアミド、エステル、アルデヒド、ケトンなども極性官能基です。
極性が非常に高い官能基=カルボン酸、アミン
極性が高い官能基 = アルコール
極性がやや高い官能基 = アミド、エステル、アルデヒド、ケトン
TLCについて詳しく知りたい!
全てのTLCの記事は以下のリンクから!