再結晶の収率計算のやり方
再結晶を行った後の収率計算の方法を解説していきます。
反応例として「アニリン」と「無水酢酸」から「アセトアニリド」を合成する反応を見てみます。
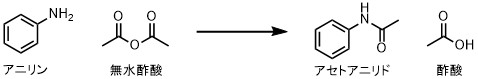
アセトアニリドの合成
1分子のアセトアニリドはアニリン1分子と無水酢酸1分子からできます。つまり、1molのアセトアニリドは1molのアニリンと1molの無水酢酸から合成されます。
再結晶によって得られたアセトアニリドの収率を計算するには理論収量を計算しておく必要があります。理論収量は完ぺきに反応がうまくいったらどのくらいのアセトアニリドが得られるか?という量です。
アニリンが1mol、無水酢酸1.2mol使ったときアセトアニリドは何モル得られるでしょうか?量は1:1の関係であるため、アセトアニリドは1.0mol得られます。無水酢酸は0.2mol余ります。余ってしまうのは計算ミスではありません。有機化学反応では片方を少し多めに加えて完全に反応を進行させるように工夫することがよくあります。
アセトアニリドは1mol得られるので、理論収量は135.17g/mol × 1 mol = 135.17gです。
実際にこの反応を行った後、得られた混合溶液を再結晶しました。
再結晶後にろ過すると68.257gの
収率は68.257 g ÷ 135.17g = 0.50497 → 50%です。
もしもカラムクロマトグラフィーなどである程度きれいな物質を80g得られていて、それを再結晶して60gとなった場合は、再結晶で20gぶん回収できていないので回収率は 60g ÷ 80g =75%です。20g分はろ液に含まれていることになります。当然再結晶を繰り返せば回収率は低下しますが、純度は高くなる傾向にあります。
再結晶の収率計算でよく起こる問題
収率が100%にならない
再結晶後に100%で得られることはありません。ろ液中に少なからず溶けてしまいます。むしろ100%になるほうがおかしいです。
再結晶を繰り返すほど純度は高くなりますが、回収率は低下します。
収率が100%を超える
収率が100%を超えたり、異様に収率が高いときは計算ミスなどを疑うべきです。よくあるのは、溶媒の乾燥不足です。水などの高沸点溶媒は乾燥しにくいのでしっかりと減圧乾燥しましょう。時には五・六十度に加熱して一晩くらい置く必要があります。細かい結晶の時は要注意です。
水溶性の高い化合物の場合は塩が混じっていたり、実は塩だったりすることがあります。TLCが見えなかったりNMRでピークが見えないときは疑ってみましょう。
理論収量の計算ミス
有機化学反応ではどちらかの試薬を多めに加えることが多いです。そのため過剰に加えているほうに着目してしまうと計算ミスをします。しっかりと化学反応式を見て量的関係を確認しましょう。
溶解度から析出量を計算する方法
溶解度があらかじめわかっている物質の場合は、溶解度から理論的な析出量を計算することができます。
再結晶の基本は温度変化に伴う溶解度の変化を利用します。
多くの化学物質は溶媒を加熱すると溶解度が大きくなります。温度に対する溶解度は物質により大きく変化します。
青線の硫酸ナトリウムに着目すると、水100mL あたり約20℃の時に20gまで溶解し、約30℃の時には50g溶解します。したがって、硫酸ナトリウムを約30℃で50g溶かして飽和溶液を作ると、その溶液を20℃まで冷却すると20gまでしか溶けないので、 50 g ー 20 g = 30 gが析出してきます。逆に20 g分は溶液に溶けてしまうので、いくら待っても結晶は得られません。
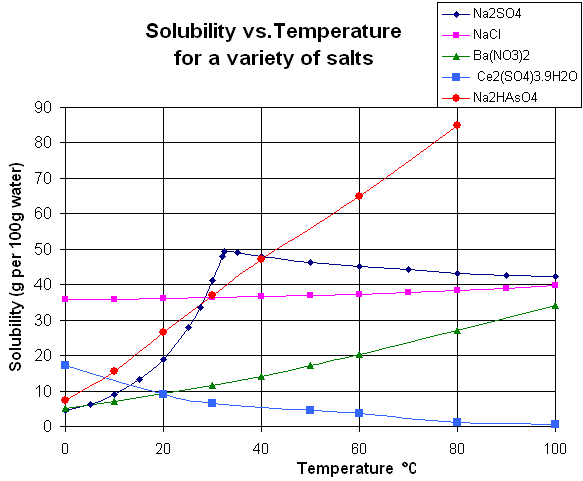
様々な塩類の溶解度曲線 from wikipedia public domain
このように溶解度が分かれば再結晶で得られる結晶の量を計算することが可能です。




