ニトロ基は強力な電子求引基として、芳香族アミン類の合成の足がかりとして重要です。ニトロ化は古くから知られている反応で今日までに多くの方法・条件が報告されています。今回はニトロ化について紹介します。
ニトロ化とは?
ニトロ化はニトロ基(-NO2)を導入する反応のことです。
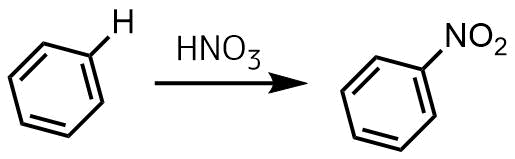
ニトロ化の反応概要
代表的なニトロ化は芳香族求電子置換反応により芳香環の水素(H)をニトロ基(NO2)に置換する反応です。
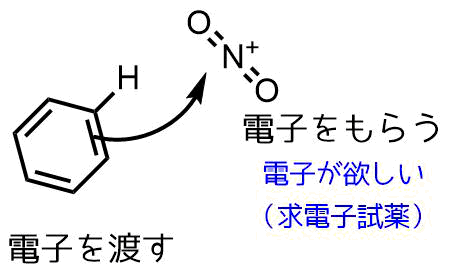
求電子置換反応の概要 求電子試薬と芳香族との反応を芳香族求電子置換反応と言う
有機化学反応においてニトロ化が重要な理由は
- 芳香族化合物の基本的な反応
- ニトロ基を足がかりに他の官能基(アミン等)に変換しやすい
したがって、試験などに出題されることも多いですし、実際にニトロ化反応を使用する機会も多いです。
最も有名かつ基本的なニトロ化反応の条件は、硫酸と硝酸の2つの酸を混合させた「混酸」を使う条件です。
1834年にMitscherich1)が報告して以来、強酸を使用する比較的激しい条件にもかかわらず、現在でも第一選択的なニトロ化反応として使われています。
反応試薬が調達容易、安価、早い、優良な結果が得られるといった点から実際に研究の現場でもファーストチョイスとして使われることが多いです。
まずこの条件を試してから条件検討ということも多いです。
ニトロ化反応の概略とニトロ基の変換
ニトロ化といえば一般的に芳香族のニトロ化、芳香環水素C-Hをニトロ基C-NO2に変換する反応が一般的ですが、他にもアミン、オキシムの酸化、アジド、ハロゲン、アルデヒドからニトロ基に変換可能です。
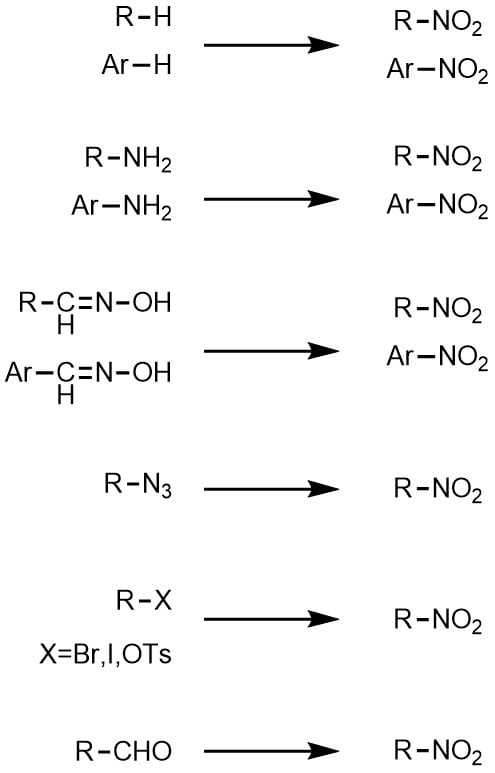
ニトロ基は還元によりアミンを得る他、水素、求核剤との置換、アルデヒド、カルボン酸、ニトロソ基にも変換可能です。
ニトロ化合物の性質と導入目的
ニトロ基はターゲット分子に対して積極的に導入されることが多い官能基です。
ニトロ化合物の性質は特筆すべきものがあります。
- 爆発性
- 電子求引性
があります。
分子の様々な性質は分子の電子状態によって変化することが多く、これらを制御するのに官能基が導入されます。
なかでもニトロ基は最強の電子求引性を持っており、ベンゼン環の電子をニトロ基が強力に引き寄せます。つまり、ベンゼン環上の電子が不足した状態・条件を用意することができます。
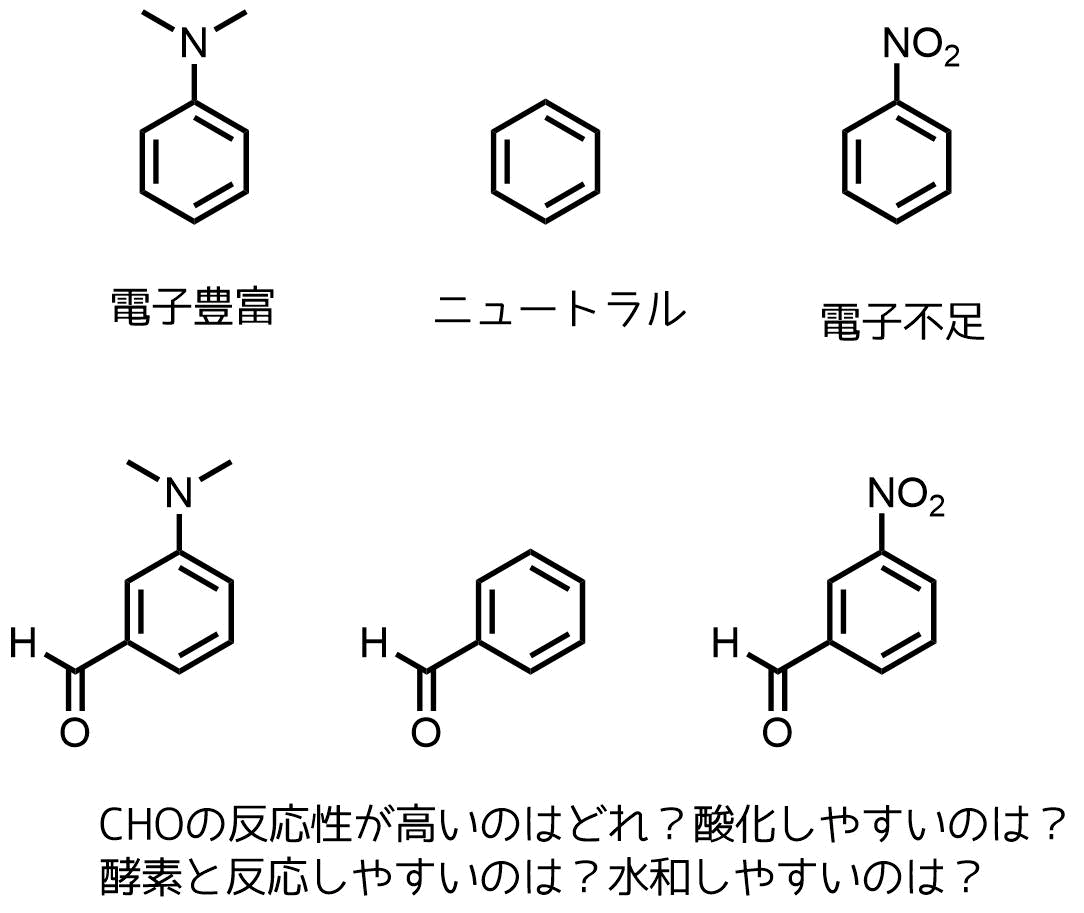
電子状態によって目的の機能を持つ分子を作ったり、その分子が変わった性質をもつ理由を解析するのに使用できる
ニトロ基入れると色がついたり、NMR等の解析で見分けやすくなったりするのでそういった目的でいれることもあります。
ニトロ化合物の爆発性
ニトロ=爆発物という印象が強いかもしません。
実際にダイナマイトの原料である「ニトログリセリン(グリセリンの硝酸エステル)」やトリニトロトルエン(TNT)などが有名どころです。
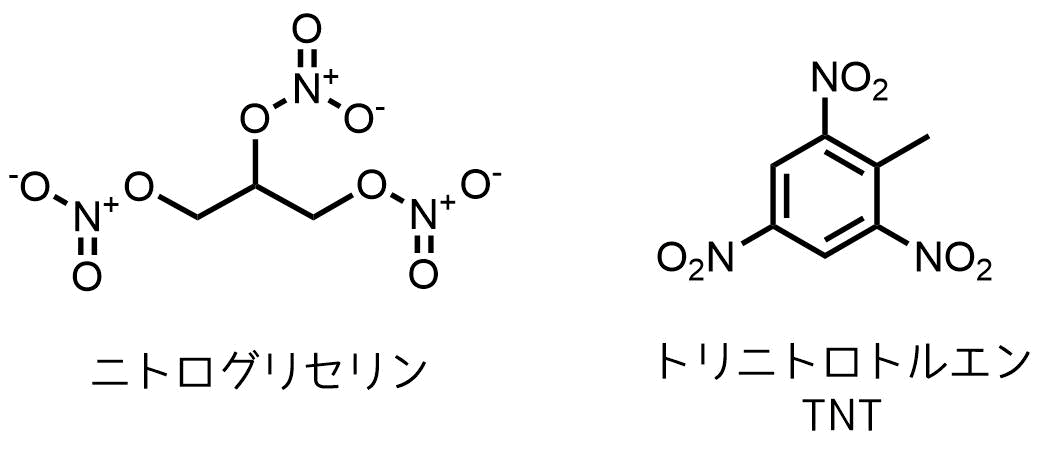
トリニトロトルエンとニトログリセリンの構造式
ニトロ基を1ついれたくらいではすぐに爆発するほどではないので怖がらなくても大丈夫です。
ニトロ化号物がなぜ爆発性を示すのか?どのような化学反応が起きているのか?という点に関して複雑で難しいです。
ニトロ基が酸素を多く含むため酸素なしで燃焼できるとか、至極安定なN2を生成するという説明がなされることがありますが、TNTは着火しても爆発しないといわれています。TNTを爆発させるためにはより簡単に爆発する物質を使って爆発させます。
これでもか!というくらいニトロ基を入れた化合物もあります。扱いたくないですね。

ニトロ基がたくさん入った爆薬
電子求引性と求電子置換反応性
最強の電子求引性を持つニトロ基は芳香環から求電子剤への攻撃性を大きく低下させます。
過剰なニトロ化試薬が入っても複数のニトロ基が入ることが少ないのはニトロ基が1つ入るだけでベンゼン環の反応性が大きく低下するからです。
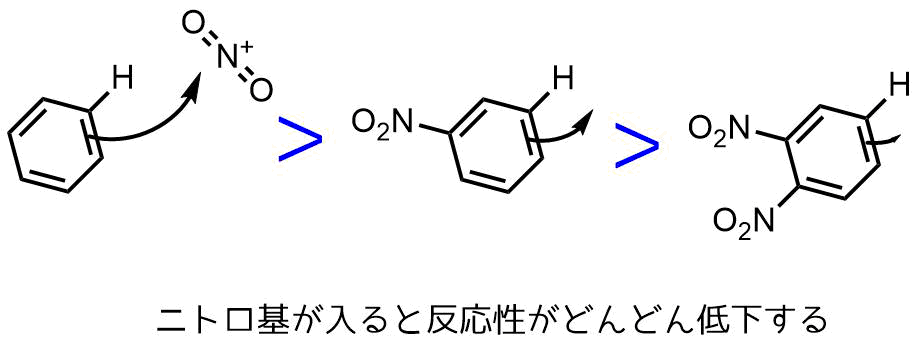
ニトロ基なし、ニトロ基1、ニトロ基2とニトロ基が導入されるほどベンゼン環上の電子密度が低下して反応性が低下する
逆にベンゼン環にニトロ基を2つ3つ入れるのは難しいです。
ニトロ化の反応機構 – 混酸の条件
ニトロ化のうち最も頻用される混酸を用いたニトロ化の反応機構を示します。
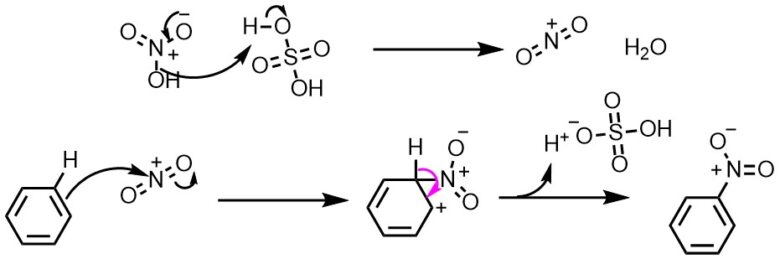
硫酸は硝酸を脱水してニトロニウムイオンを生成します。芳香環の電子がニトロニウムイオンに攻撃し、ニトロ化が進行します。反応機構からわかるように硫酸がなくてもニトロ化が進行します。
芳香族化合物のニトロ化反応の例
ニトロ化反応は早く、発熱的に進行するため、通常は冷却しながら行います。
温度が高くなると副反応が起きるので注意しましょう。
求電子置換によるニトロ化
硝酸を用いたニトロ化
硝酸だけ使うニトロ化は最もシンプルな方法です。
硝酸は電子豊富な芳香環のニトロ化に使われます。
硝酸の代わりに、二酸化窒素が溶けた「発煙硝酸」や「無水硝酸」(等量の濃硫酸との蒸留によって得られる)なども同じように使うことができます。
アニリンなどの電子豊富な芳香族化合物は酸化を受けやすいので注意しましょう。
硝酸の前処理
高濃度の硝酸中に含まれる酸化作用の強い亜硝酸は副反応(酸化)の原因となるため尿素処理により除去してから反応すると良い結果が得られるかもしれません。
方法は、硝酸500 mLに対して尿素3gを加えて10分間加熱撹拌後、冷却してして利用します。
混酸を用いたニトロ化
最も基本的な方法は、混酸は「硫酸」と「硝酸」を使ったニトロ化法です。
硝酸だけ用いるよりも反応性が高いです。
硫酸は硝酸から反応性の高いニトロニウムイオン(NO2+)を発生させるために加えています。
混酸を用いた反応は発熱的に進行するため副反応を抑えるために低い温度(-20℃~50℃)を保って反応させるのがポイントです。
ニトロ化反応を行う時は発熱するためゆっくりと加えたり氷浴を使って温度管理に気をつけましょう。温度が上がって副反応が起こると酸による分解やポリニトロ体などが生じることがあります。
- 硝酸のみよりも高反応性
- 硝酸のみよりも溶解性に優れる(低温では溶けない場合も多い)
- 十分に冷却した状態で反応させる
- 数分で反応が終了することもある
- 後処理で温度を挙げないように注意する
- 大量の酸の後処理が面倒なのが欠点
第3,4族金属塩(ランタノイドを含む主にTf塩)を使ったニトロ化
硝酸、混酸のニトロ化は過剰量の試薬を加えることが多く複数の反応点がある際にニトロ基が複数導入される恐れがあります。
10mol%程度の金属塩を触媒として加えてニトロ化を行う方法は等モルの硝酸を用いて反応させることができるので、ニトロ化を制御しやすく、副反応も抑えることができるのが利点です。
使用される金属は、Sc、Yb、Hf、La,などのトリフラート塩などがよく用いられます。
不活性な芳香環(o-ニトロトルエンや1,3,5-トリフルオロベンゼン)などには、Hf(OTf)4、Zr(OTf)4やあるいはSc(CTf3)3やYb(CTf)3が有効です。混酸のニトロ化は1時間程度と短いですが、トリフラート塩を使った場合、反応時間は24時間前後と長いです。溶媒には1,2-ジクロロエタンなどが用いられています。反応溶液は二層となって有機層はニトロ化に伴い黄色く色づいていき、反応とともに境界は分かり難くなっていきます。トリフラート塩は回収・再利用可能です。(水層を回収して濃縮すると回収できる)
Barrett, Anthony GM, et al. “Lanthanide triflate and triflide catalyzed atom economic nitration of fluoroarenes.” Synlett 2000.01 (2000): 57-58.Kobayashi, Shū, et al. “Rare-earth metal triflates in organic synthesis.” Chemical reviews 102.6 (2002): 2227-2302.
硝酸アセチルによるニトロ化(無水酢酸ー硝酸系)
硝酸と無水酢酸により生成する硝酸アセチルを使ったニトロ化は、酸化や加水分解に対して敏感な官能基を持つ芳香環のニトロ化に使われます(アセトアニリドやアニソール、不飽和アルデヒド、エステルなど)。
無水酢酸と発煙もしくは濃硝酸を塩氷浴中で混合させて調整します。硝酸源として硝酸銅も使えます。
欠点としては、硝酸アセチルの爆発性があるので、20℃以下で取り扱うようにします。アミドなどの置換基に対してオルト選択性があります。
テトラフルオロボレート塩(BF4-NO2)を使ったニトロ化
硝酸を使用せずにニトロ化できるため、水が混入せず、酸加水分解に弱い官能基(シアノ、エステル等)を含むものでもニトロ化できるメリットがあります。
また、反応性の低い芳香環もニトロ化にも向いていて、例えば反応溶液をフルオロスルホン酸中で行えば、かなり不活性なメタジニトロベンゼンをもニトロ化することができます。
NO2BF4を用いる方法は、非水系で非酸性(HBF4は副生する)で反応を行えます。芳香族化合物を3倍量程度に過剰に加えるとジニトロ化を抑えられ、アルキル基、ハロゲン(フッ素とか)、ニトロ、エステル、シアノ基を有するものでも短時間(30分)、低温度(5-50℃)でモノニトロ体が得られます。
NO2BF4は固体もしくはスルホラン溶液のものが売られています。この試薬のデメリットは溶解性が悪さで、スルホランやアセトニトリル(最も溶ける)にしかとけません。また吸湿性の高いので湿気を避けます。
ニトロニウムトリフルオロメタンスルホナート(NO2+Tf–)を使ったニトロ化
TfO2と濃硝酸との反応により調整されるNO2+Tfーは溶解性が高く。溶媒としてはニトロメタン、ジクロロメタン、四塩化炭素、ペンタン、硫酸、TfOHを用いることができます。反応性が高くトルエンなどのモノニトロ化には-78℃から徐々に0℃にして反応させる方法をとる。不活性なF、Cl、NO2、CF3ベンゼンのモノニトロ化は0℃~室温で反応させて得ます。
NO2B(CF3SO3)4- ニトロニウムーテトラキストリフラートボラートによるニトロ化
この試薬は反応性が高く、特に不活性なニトロ化に対して有効です。ペンタフルオロベンゼンなどより不活性なベンゼンのニトロ化も室温3hで可能です。本試薬は三塩化ホウ素+TfOHに硝酸を加えて、系中で発生させる。
五酸化二窒素を使ったニトロ化
硫酸や熱に対して不安定な基質に対して有効です。発煙硝酸と五酸化リンによる脱水、蒸留により得ます。条件は過激なため大量合成には向いていません。反応性はかなり高く、不活性でない芳香環とは爆発的に反応するために使用は避けるべきです。
トルエンは(0℃で10分, quant)で得られます。Fe(Acac)3触媒は反応性を劇的に向上させ、トルエンは-100℃で定量的にニトロ化され、ベンズアルデヒドも0℃4minで定量的にニトロ化が進行します(o:m:p=18:60:22)
ピリジンのニトロ化にも有効で、ニトロメタン、NaHSO3存在下のニトロ化は70%程度で得られます。(混酸は3%程度)
京大法(オゾン、二酸化窒素)によるニトロ化
オゾンと二酸化窒素を使用する京大法は低温、中性条件でニトロ化できるメリットがあります。
少量の酸を添加するとさらに反応性が高まり、複数のニトロ基を導入するのにも役立ちます。
ただしオゾンガス、二酸化窒素ガスを用意するのは難しいかもしれません。
スチレンのニトロ化は側鎖のニトロ化が進行してしまいます。芳香族ケトン、アニリド、多縮環芳香族化合物のニトロ化が成功しています。
金属硝酸塩(亜硝酸ナトリウム、カリウム)を用いたニトロ化
硫酸と亜硝酸ナトリウムなどを用いる方法は固体であることから正確に秤量できる点が利点です。
固体酸を用いた方法
硝酸を使用する方法は大量の酸廃液が発生するのが欠点です。
液体酸の代わりに、ゼオライトやモンモリロナイトなどの固体酸の使用することで、より安全かつエコな反応が実現できます。
また、液体酸とは異なる選択性が得られることがあります。
例えばゼオライトは多孔質構造で小さな孔に取り込まれた際に立体的な影響で選択性が変化する可能性があります。
マイクロウェーブの利用
マイクロウェーブ照射はニトロ化にも有効な場合があります。Sodium nitrateと酢酸で、フェノールのモノニトロ化に数分で高収率で変換できます。希硝酸と酢酸を用いた条件でもマイクロウェーブが利用可能です。
求核置換によるニトロ化
ザンドマイヤー反応(アミン→ニトロ)
アミンをジアゾ化し、亜硝酸ナトリウムで処理するとニトロ体が得られます。有名な人名反応です。
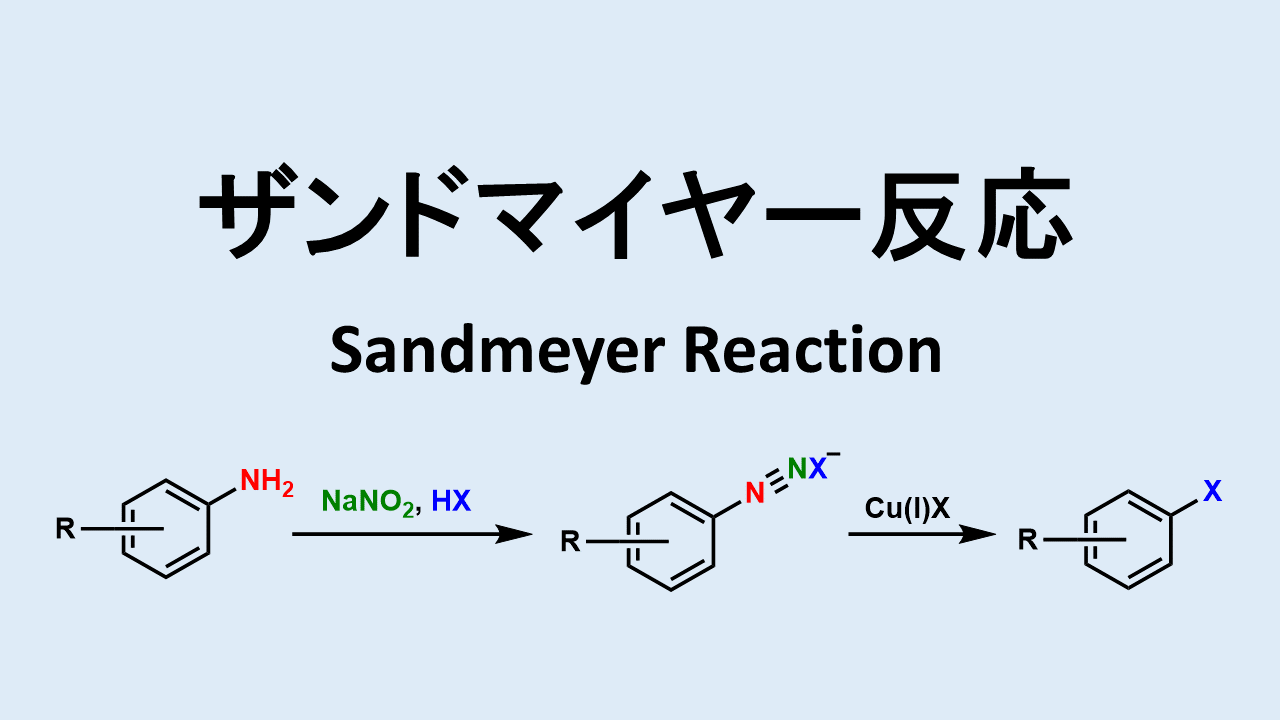 ザンドマイヤー反応: Sandmeyer Reaction
ザンドマイヤー反応: Sandmeyer Reaction
酸化によるニトロ化
アミンの酸化
過酢酸、過ホウ酸ナトリウム、オキソンーアセトン、ジメチルオキシラン、などが酸化剤として利用されます。ハロゲン、ヒドロキシ、メトキシを含むアミンをニトロ化したいときに使います。酸化剤ではオキソンが便利でおすすめです。
1) Mitscherich, E. Annln. Phys. Chem. 1834 , 31, 625.
ボロン酸からニトロ化
芳香族求電子置換反応をベースとしたニトロ化は位置選択的にニトロ化するのが難しいという欠点があります。
特定の官能基をニトロ化するイプソニトロ化反応は選択的にニトロ化できるので有用です。
フェニルボロン酸は無水トリフルオロ酢酸と硝酸アンモニウムから生成するCrivello reagentによってニトロ化可能であることが報告されています。
Salzbrunn, Stefan, et al. “Regioselective nitration of arylboronic acids.” Synlett 2000.10 (2000): 1485-1487.
tBuONOを用いることによりイプソニトロ化可能であることが報告されています。

B(OH)2 -> NO2
ボロン酸 1mmol, ジオキサン 2mL, tert-butyl nitrite(10mmol)を加えてセプタム栓をして80℃ 16h 反応を行い、室温に戻したあと、濃縮、クルードをシリカゲルカラムクロマトグラフィーにて生成して目的物を得た
Wu, Xiao-Feng, et al. “Convenient and mild synthesis of nitroarenes by metal-free nitration of arylboronic acids.” Chemical Communications 47.46 (2011): 12462-12463.
アリールボロン酸(1.0eq)、NH4NO3(2.2eq)、TMSCl(2.2eq), CH2Cl2中室温で反応させることにより中程度の収量でニトロ体が得られる。
Prakash, GK Surya, et al. “Ipso-nitration of arylboronic acids with chlorotrimethylsilane− nitrate salts.” Organic letters 6.13 (2004): 2205-2207.
Zarei, Mahmoud, et al. “Synthesis of nitroolefins and nitroarenes under mild conditions.” The Journal of organic chemistry 83.7 (2018): 3645-3650.
トリフルオロボレート塩からニトロ化
トリフルオロボレート塩からニトロソ基を経由してニトロ化も可能です。
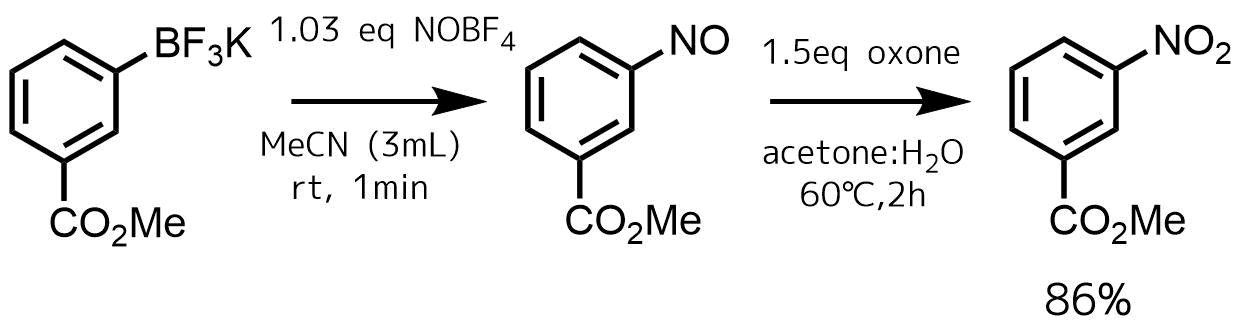
BF3Kからニトロ化
アリールトリフルオロボレート塩はニトロ基等の電子求引基があっても良好な収率でニトロ化が進行します。
Molander, Gary A., and Livia N. Cavalcanti. “Nitrosation of aryl and heteroaryltrifluoroborates with nitrosonium tetrafluoroborate.” The Journal of organic chemistry 77.9 (2012): 4402-4413.
塩化アリールからニトロ化
塩化アリールやアリールトリフラートからパラジウム触媒を用いてニトロ化する方法が報告されています。
触媒はPd2(dba)3、リガンドはtBuBrettPhos(ardrichで販売)を用いてニトロ化可能です。ハロゲン化アリールは入手が容易であり、電子供与、電子求引基が入っていてもニトロ化可能です。
酸を用いない穏和で位置選択的なニトロ化に向いています。
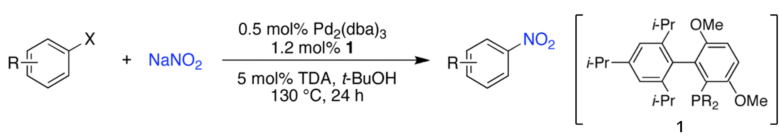
Fors, Brett P., and Stephen L. Buchwald. “Pd-Catalyzed conversion of aryl chlorides, triflates, and nonaflates to nitroaromatics.” Journal of the American Chemical Society 131.36 (2009): 12898-12899.
脂肪族化合物のニトロ化の例
脂肪族化合物のニトロ化は芳香族のように混酸を用いた求電子置換反応は通常は進行しません。ハロゲンをニトロ基に置換する方法やオレフィンに付加させて合成する方法が一般的です。アミノ基を酸化してニトロ基を得る方法もあります。


第3,4族金属塩(ランタノイドを含む主にTf塩)を使ったニトロ化の参考文献はありませんか。
お読みいただいてありがとうございます。
La(OTf)3に関しては以下のレビューがリサーチゲートから入手できます。
https://www.researchgate.net/publication/274065857_Lanthanide_III_Triflates_as_a_Novel_Recyclable_Catalysts_for_Unit_Processes_in_Chemical_Industry-_A_Review
Chemical reviewでレアアースメタルのトリフラート塩の有機合成への応用のレビューにも芳香族ニトロ化についての章があり、役に立つと思います
https://pubs.acs.org/doi/full/10.1021/cr010289i
他にはLaについては
Waller, FrancisáJ, AnthonyáG M. Barrett, and D. áChristopher Braddock. “Lanthanide (III) triflates as recyclable catalysts for atom economic aromatic nitration.” Chemical Communications 6 (1997): 613-614.
よりニトロ化に活性が高いHfなどについては
Barrett, Anthony GM, et al. “Lanthanide triflate and triflide catalyzed atom economic nitration of fluoroarenes.” Synlett 2000.01 (2000): 57-58.
などがあります。ほかに気になることがあればお気軽にお問い合わせください。
p-ニトロアセトアニリドを硫酸を使って加水分解させてp-ニトロアニリンを合成する反応式ってどうなりますか??
いったんアニリン硫酸塩が生じるのでしょうか??
教えていただけると嬉しいです!!
質問はどんなものでも歓迎です
おっしゃる通り希硫酸で加水分解した場合はアニリン硫酸塩が生じます。この塩からp-ニトロアニリンを取り出したい場合は水酸化ナトリウムなどの強塩基を加えてアニリンを遊離させなければなりません(酸性塩のアニリン硫酸塩と水酸化ナトリウムが反応して硫酸ナトリウム(中性)とアニリンと水が生成)。
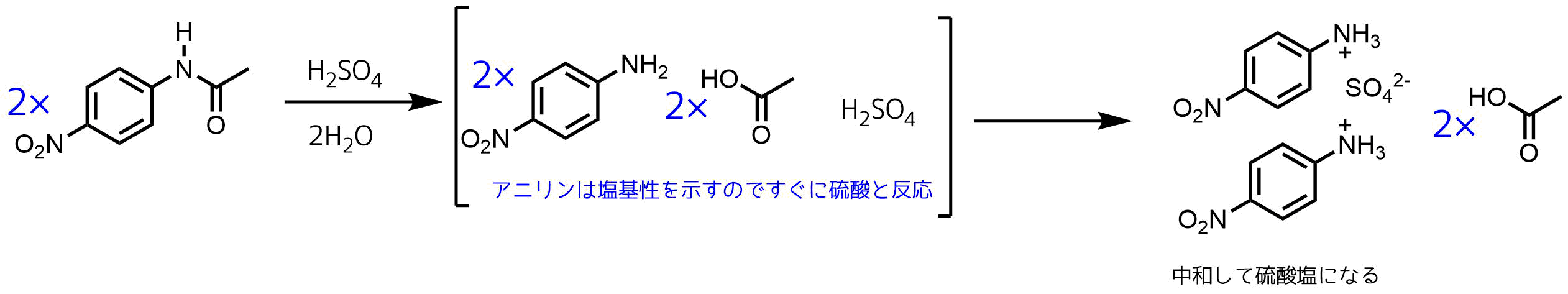
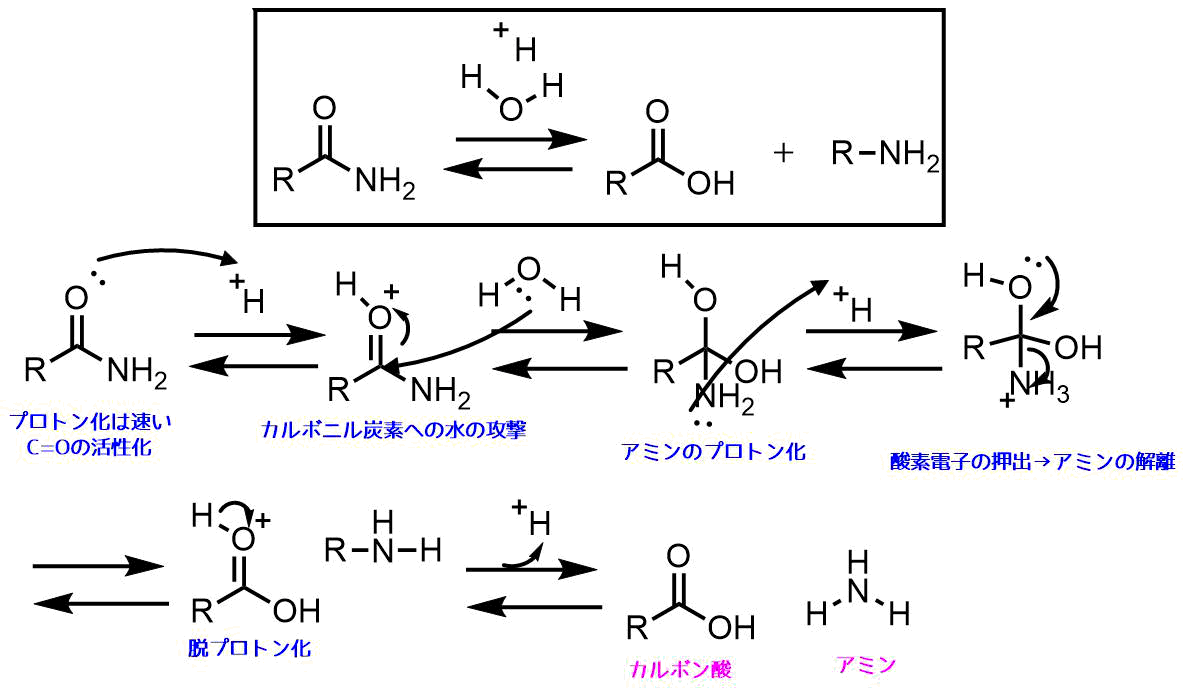
p-ニトロアセトアニリドの酸加水分解の反応機構については一般化すると酸アミド(アセトアニリド)の酸加水分解反応によってカルボン酸(酢酸)とアニリン(アミン)を生成する反応となります。この反応機構は以下のようになります。
CH3CONH2をp-ニトロアセトアニリドとすれば同じになります。
アミドの加水分解に関する有機化学反応については以下の記事で紹介しているので興味があれば見てみてください
アミドの加水分解反応でアミンとカルボン酸を得る/
また何かあれば遠慮なく質問してください
ニトロ基はどのような反応を経てイソシアネートに変換できますでしょうか?
実験に使用するうえで必要な溶媒なども教えていただけると幸いです。
よろしければそれに関する文献、論文も知りたいと思っています。
ニトロ基(R-NO2)からどのような反応を経てイソシアネート(R-CNO)を得られますでしょうか?
実験で使用する溶媒なども教えていただけると幸いです。
参考になりそうな文献もありましたら教えていただきたいです。
芳香族ニトロ化合物からイソシアネートを合成するには、金属触媒(塩化ロジウムや塩化パラジウムおよび酸化物)、一酸化炭素を用いて合成します。還元的カルボニル化(reductive carbonylation)と呼ばれています。
WEIGERT, F. J. Synthesis of aryl isocyanates from nitro compounds and carbon monoxide. The Journal of Organic Chemistry, 1973, 38.7: 1316-1319.の論文では芳香族ニトロ化合物を塩化パラジウム触媒下一酸化炭素によりイソシアネートの合成を報告しています(高圧の一酸化炭素を要するのが欠点)
イソシアネートは不安定なため単離せずにウレアやカルバメートに変換する方法もやられているようです。
他にも
NGUYEN, Thanh Tung, et al. Palladium-catalyzed reductive carbonylation of nitrobenzene for producing phenyl isocyanate. Tetrahedron Letters, 2019, 60.50: 151310.
Wehman,P.; Dol, GC; Moorman, ER; Kamer, PCJ; van Leeuwen, PWNM; Fraanje, J.; Goubitz, K.Organometallics 1994, 13, 4856-4869
2) perspective
RAGAINI, Fabio. Away from phosgene: reductive carbonylation of nitroarenes and oxidative carbonylation of amines, understanding the mechanism to improve performance. Dalton Transactions, 2009, 32: 6251-6266.
Paul, Frédéric. “Catalytic synthesis of isocyanates or carbamates from nitroaromatics using Group VIII transition metal catalysts.” Coordination Chemistry Reviews 203.1 (2000): 269-323.
混酸を用いたニトロ化について、参考文献はありますでしょうか?
混酸を用いたニトロ化は教科書に載るくらい一般的なため論文よりも書籍が参考になります。
実験手順であれば日本語で読める
・実験科学講座第5版14巻 が良いです
(版ごとに内容が違うので、別版も参考になります。特に古い版)
・アイオワ州立大学の博士論文
Modic, Frank Joseph. Some studies on aromatic nitration. Iowa State University, 1951.
https://lib.dr.iastate.edu/cgi/viewcontent.cgi?article=14725&context=rtd
博士論文はストーリー性があるのでreviewと比べて読みやすく参考文献もあるので内容が合致する場合はおすすめです
論文
・Zaldivar, J. M., et al. “Aromatic nitrations by mixed acid. Fast liquid-liquid reaction regime.” Chemical engineering and processing: process intensification 35.2 (1996): 91-105.
・