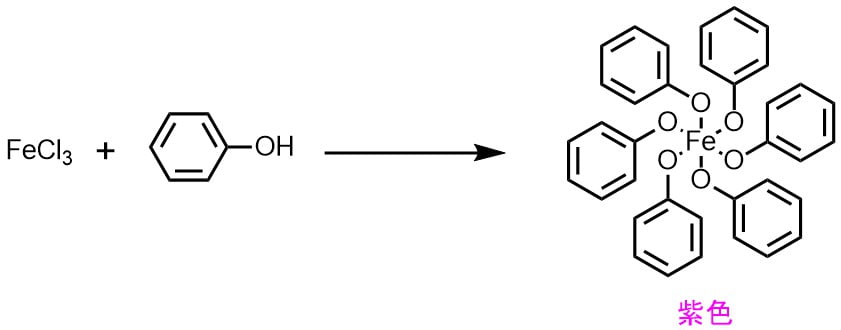
塩化鉄(III)(FeCl3)はフェノールの発色試薬
塩化鉄(III)はフェノール類を選択的に染色するTLCの発色試薬です。塩化鉄(III)・FeCl3によるフェノール類の呈色は塩化鉄との錯体形成によるもので、フェノールの種類によって呈色されにくいものもあります。
塩化鉄(III)で染色すると淡黄色の背景にスポットは紫から緑、黄褐色など化合物によって様々な色の呈色が見られます。
塩化鉄 (FeCl3)によるフェノール呈色の原理
塩化鉄(III)とフェノールとが錯体を形成することによって呈色することが知られています。
フェノール呈色の選択性
塩化鉄によるフェノールの呈色は、フェノールの種類によって異なることが知られています。また、アルコールの影響で呈色が妨害されるため、エタノールで塩化鉄(III)溶液を調製した場合は、呈色されなかったり弱く呈色される傾向があります。
エタノール溶液では呈色が弱いもの
- フェノール (PhOH)
- クレゾール類
- o-ニトロフェノール
- p-メトキシフェノール
これらは水溶液中ではよりはっきりと呈色しますが、メトキシフェノールに関しては水溶液でも発色しにくいです。
・長谷川正, and 臼井豊和. “塩化鉄 (III) によるフェノール類の呈色反応.” 化学と教育 39.4 (1991): 456-457.
・長谷川正, and 臼井豊和. “塩化鉄 (III) によるフェノール類の TLC 上での呈色挙動.” 化学と教育 39.6 (1991): 686-687.
・佐々木克敬, et al. “フェノール類の塩化鉄 (III): による呈色反応.” 化学と教育 40.10 (1992): 702-703.
塩化鉄(III)・FeCl3発色試薬の作り方
塩化鉄IIIの発色試薬はエタノールと水で溶解したものの二種類あります。エタノールを溶媒としたほうが発色が弱い傾向があります。水とエタノール溶液とでは、呈色が若干異なるのでフェノールの構造推定に利用できるかもしれません。
塩化鉄 (III)エタノール溶媒
- FeCl3・6H2O 1 g
- 水 5 mL
- エタノール 95 mL
塩化鉄(III)六水和物 1gを水 5 mLに溶解した後エタノール95 mLを加えて調製します。
塩化鉄 (|||)水溶液
- FeCl3・6H2O 2 g
- 水 100 mL
水 100 mLに塩化鉄(III)を2 g加えて溶解して調整します。
塩化鉄(III)・FeCl3発色試薬の保存方法
室温で保存しておくと徐々に沈殿ができてきます。冷蔵庫に保存するのが推奨されているようです。寿命は短めで1週間ほどでダメになってしまうようです。
塩化鉄(III)・FeCl3発色試薬の使い方と特徴
展開したTLCを塩化鉄(III)・FeCl3発色試薬にディップまたは噴霧した後、加熱します(110℃-5min)。加熱する前から発色するものもあります。背景は淡黄白色です。スポットの色は化合物によって様々です。フラボノイド類は赤、紫、緑、赤茶色に染まり、カテコール類は緑や青色、塩類は黄色っぽい色に呈色します。通常は紫や緑っぽい色が多く、黄色や赤褐色系に発色することもあります。感度はそこまで高くないような印象があります。
発色するか化合物はフェノール類全般(フラボノイド類、タンニン類カテコール、フェノチアジン)、エノール類、ヒドロキサム酸、セレン類などがあります。
塩化鉄との錯体形成が呈色の機構であるため、フェノール類でも電子供与性基が多い酸化されやすいフェノール類は呈色されにくいです。一方でp-ニトロフェノール類など電子求引性基を持つフェノール類は呈色しやすいです。また、酸の存在で呈色が妨害されるという報告があり1)、p-ヒドロキシ安息香酸などのカルボン酸があるものは呈色しにくいです。
1)日本化学 会編,”続 実験化学 講座5(上)”,丸善 (1965,pp.446−452.
全てのTLCの記事は以下のリンクから!