合成上有用なエステルの製法として有名なフィッシャー・エステル化は単純ながら化学平衡や加水分解・脱水など化学の基本的な知識が詰まっている反応であることから、教科書やテスト、化学実験などの題材になる定番の反応です。
ここではエステル化の王道であるフィッシャーエステル化について原理や方法、特徴などを紹介していきます。
エステル合成の王道!フィッシャーエステル化
エステル(RCOOR’)は花や果物の香り成分や溶剤(除光液、シンナー)など日常でも重要な物質です。
そんなエステルの最も一般的な合成法はカルボン酸+アルコールを脱水縮合する方法です。
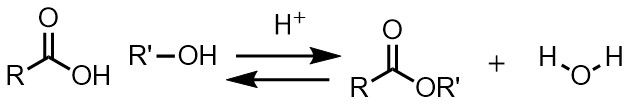
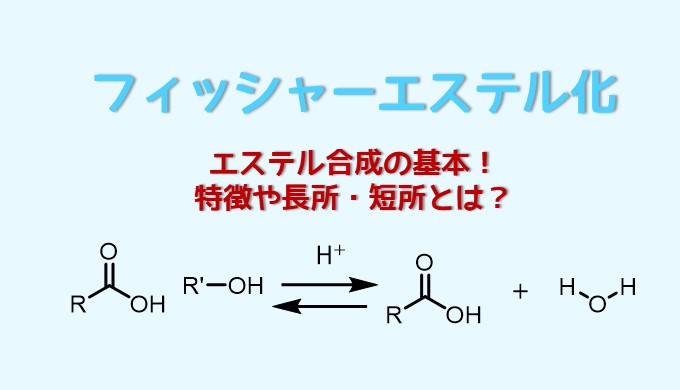
エステル化の反応式
酸触媒のもとエステル化する方法を「フィッシャーエステル合成」と呼んでいます。
1895年ノーベル賞化学賞を受賞したエミール・フィッシャーとアルトゥル・スぺイアによって報告されました(Darstellung der Ester”. Chemische Berichte 28: 3252–3258)。
しかし、ただエステルができるという反応ならば「フィッシャーエステル化」という名前がつくほどのものではなかったかもしれません。
ところでカルボン酸はどうやって合成するかと言うと、「エステル」+「水」で合成することができます。
つまり上の「エステル合成」の逆反応ということです。
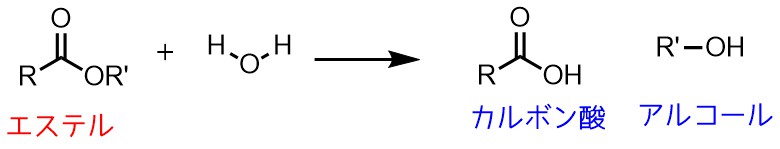
エステルを合成する反応の逆はカルボン酸とアルコールを作る反応!
したがって、エステルを作る反応はカルボン酸とアルコールを反応させてエステルを合成しながら、せっかくできたエステルは副生成物の水で分解してカルボン酸とアルコールに戻るという反応が同時に起こる厄介な反応なのです。
エステルをたくさん作れば作るほど、水によりエステルが分解される量も増えてきます。どうすればエステルだけを合成することができるでしょうか?
加水分解と脱水縮合
化学反応の重要なキーワード?に加水分解と脱水縮合があります。フィッシャーエステル化はこの好適な例です。
脱水縮合:反応により水が生成する反応。エステル化ではカルボン酸とアルコールから水が生成してエステルとなる。
加水分解:水が使用される反応。エステルに水が反応するとカルボン酸とアルコールが生成する。
まずはカルボン酸とアルコールをどうやって反応させるか?
反応式で書くのは簡単ですが、実際に反応させるとなると単純な化合物でも難しいのが有機化学の面白いところです。
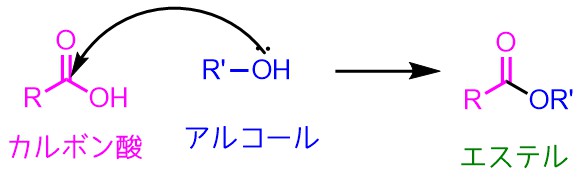
カルボン酸のC=O結合の炭素にアルコールの酸素が結合を作っているように見える
身近なカルボン酸である酢酸(お酢の成分)とエタノール(お酒)を混ぜてたら、酢酸エチル(パイン様臭・セメダイン臭)ができるかというと
できないのが現実です。それは、カルボン酸の反応性が低いのが原因です。
カルボン酸のC=O結合の炭素に対してアルコールの酸素が結合を形成するのが第一段階ですが、これがカルボン酸の反応性が低いために進行しにくいです。
カルボン酸の炭素は電気陰性度の高い酸素によって電子が引っ張らていると考えると炭素は電子不足であり、アルコールの酸素は電子をたくさんもっているので電子不足の炭素と結合形成するのはそんなに難しくないように見えます。(実際にケトンRC=ORやアルデヒドRC=OHは反応しやすい)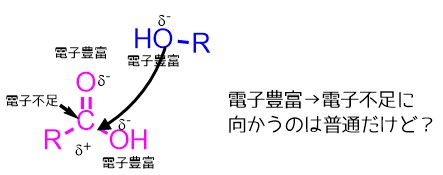
ただしカルボン酸は酸ということも有り、水素を放出しやすいです。これによって生成するカルボキシラートイオンは電子を酸素同士で炭素を介して非局在化します。このような形を取ると分子が安定化されているのでカルボン酸の反応性は低下しています。
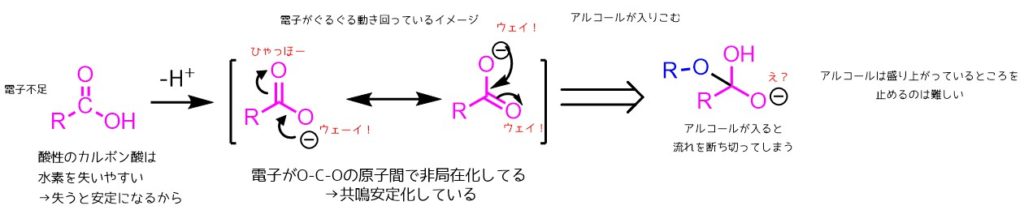
カルボン酸の反応性を上げるにはカルボキシラートイオンにさせないという方法が考えられます。
そこで使うのが、「酸触媒」です。
極端な例では、強酸の濃硫酸を加えると本来H+を放出する酢酸でもプロトン化されます。これによって脱水が起こって反応性の高いアシリウムイオンが生成します。このアシリウムイオンはもはや共鳴はできず、アルコールと反応させるとエステルができます。
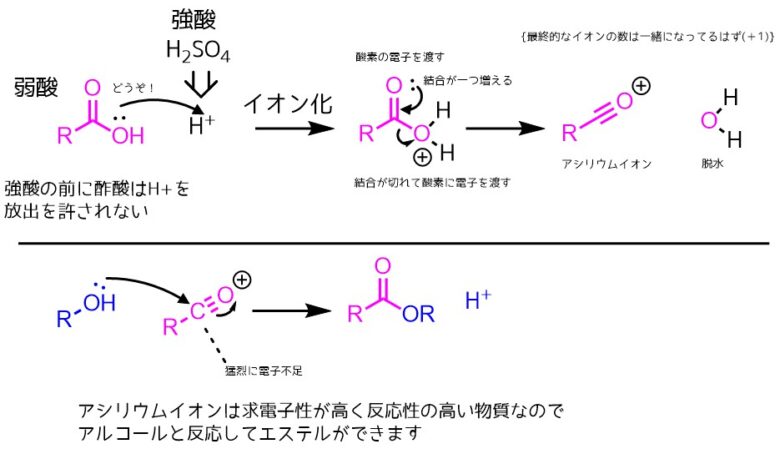
エステル化の反応機構
しかし、濃硫酸中に晒すというのは人間と一緒で化合物にとっても過酷な条件です。
実はもう少し酸の量を減らしても実はカルボン酸との反応は進行します。
酸の量は触媒量といって少量だけで良いです。
アシリウムイオンは発生せずとも、酸素のプロトン化によってカルボニル炭素の求電子性を上げることができます。
酸触媒としての意味は脱水の促進にもあります。
酸触媒がなければ塩基性の高い水酸化物イオン(OHー)が生成します。このような反応性の高い物質が生成するような反応は進行しにくいです。
一方で酸触媒があるとOH-がプロトン化されて水になります。より安定な水は脱離しやすくなります。
「酸は水酸基の脱離能を上げる効果」があります。
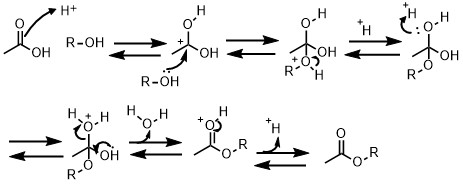
フィッシャーエステル化の収率を上げる方法
今度は実験編です。
例えアルコールが反応してエステルができても、逆の反応を抑えることができなければ、元に戻ってしまいます。
しかし、化学反応は手を加えることが可能です。なんとかエステルだけを合成する方法を考えてみましょう。
もう一度化学反応式を見てみます。エステルを得たいということは、
右に行きやすくして、左に行きにくくすれば良いです。

- アルコールを過剰に用いる(右に進行しやすくなる)
- 水を除去する(左にいかなくなる)
- エステルを取り出す(左にいかなくなる)
が挙げられます。
この反応ではカルボン酸1モルに対して、水は1モルできます。
アルコールを100倍量の100モルとしても生成する水の量は1モルです。つまり、たくさんのアルコールを加えることで、生成したエステルが水と反応しにくくできます。例え反応してもその100倍の量のアルコールが控えています。
水を除去すれば、エステルが加水分解することもありません。
同じ考え方で、エステルを取り出してしまえば、水と反応することはありません。
このように手を加えることで反応を右に偏らせることが可能です。
実験方法・反応条件
実際の実験の操作方法を紹介します。アルコールは使えるなら大量に入れたほうが良いです。メチルエステルやエチルエステルなどではメタノールやエタノールを溶媒として使うことも多いです。
酸触媒
フィッシャーエステル合成に利用する酸としては、
- 硫酸
- 塩酸
- p-トルエンスルホン酸(pTSA)
- 三フッ化ホウ素(BF3)
などがあります。
1.硫酸
濃硫酸は安価でよく使用されます。利点は硫酸イオンの反応性が低く副反応を起こしにくいこと、不揮発性のため生成物のエステルを蒸留で回収しやすい点があります。
一方で強酸性のため酸に弱い原料では別の酸のほうが良いかもしれません。
2.塩酸
塩酸は硫酸よりも取り扱いやすい試薬です。揮発性のため、酸に不安定でなければ、反応後に濃縮・共沸だけで目的物が得られます。逆にエステルを蒸留精製するときは向きません。
また、塩酸は塩化物イオンの求核性があるため多重結合への付加反応が起こる可能性があります。その場合は別の酸を使います。
メチルエステルなどを作る時は塩酸を加えるのではなく、HCl-MeOHなどを利用したほうが効率的です。
3.p-トルエンスルホン酸
p-TSAは有機溶媒に可溶な酸であり、酸触媒として多用されてます。硫酸と比べて取り扱いやすく、トルエンでディーンスターク装置などを使って加熱還流するときなどはp-TSAを使うことが多い気がします。無水物でも水和物でもどっちでもOKです。
4.三フッ化ホウ素
BF3は代表的なルイス酸であり、有機溶媒に可溶性な酸触媒としてよく使われます。高価であること、除去しにくい点が欠点です。
以上が特徴です。
酸の量としては、カルボン酸に対して0.1-0.3当量くらいの酸を加えれば十分です。
水の除去・脱水剤の利用
1.水を物理的に除去する
2.水と反応する脱水剤を使って除去する
物理的な除去はディーンスターク装置を使用するのが便利です。
カルボン酸とアルコールを水と混じらないトルエンなどの溶媒と共に加熱すると、水はトルエンと共に蒸発していきます。蒸発した気体を冷却管で凝縮させたものを一時的に集めて分離した水分のみを捨ててトルエンを反応容器に戻すという装置です。このディーンスターク装置は低沸点のアルコールには向いていません。
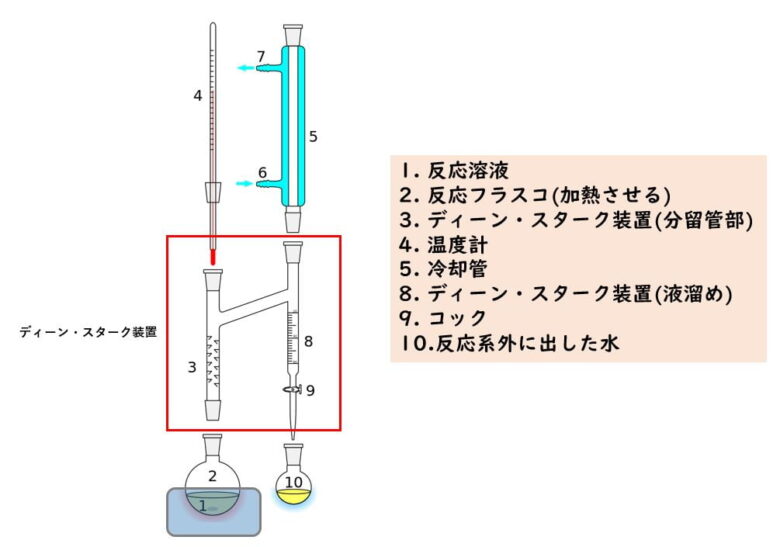
ディーンスターク装置の概要
2.水と反応する脱水剤を使う
脱水剤として有名なものにはモレキュラーシーブがあります。モレキュラーシーブは水を孔の中に吸着して除去する能力があります。脱水溶媒を調製するのにも使われています。
ソックスレー抽出器に脱水剤を詰めて凝縮させた溶媒から水を抜き取って戻します。
脱水剤は
- モレキュラーシーブ3A
- 無水硫酸マグネシウム
- 五酸化二リン
- 炭化カルシウム
- オルトエステル・アセタール類(DMP, オルトギ酸トリメチル)
などが使えます。
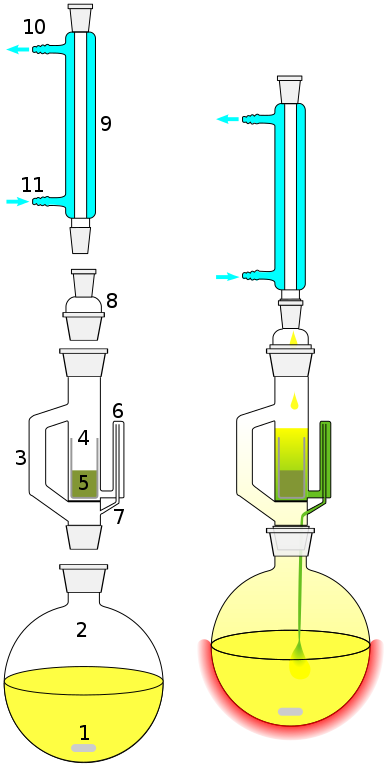
ソックスレー抽出器(4の装置) from wikipedia public domain
酸触媒の利点は?なぜ塩基を使わない?
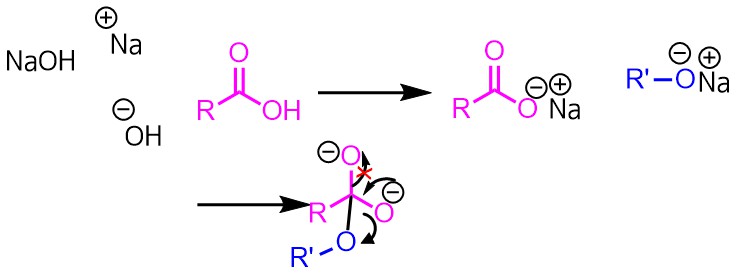
塩基を加えた場合はカルボン酸塩とアルコキシドができたとして、反応しても酸素がO2-としては外れないので、エステル化は進行しない。
フィッシャーエステル化の欠点
フィッシャーエステル化の欠点は
- 酸触媒を使うので酸に不安定な物質は使えない
- 熱をかけるので熱に不安定な物質は使えない
- 分子内にエステルやアミドがあるとエステル交換する可能性がある。
- アルコールが高価・貴重なものには向かない
- フェノール等の酸性度の高いアルコールはエステル化しにくい
という点があげられます。
フィッシャーエステル化の欠点は酸触媒を使うことです。酸に対して不安定な構造を持っている化合物はこわれてしまうのでこの方法ではエステル化はやりにくいです。
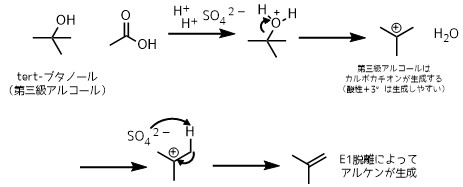
第三級アルコールは酸性条件で脱水してアルケンが生成するため、フィッシャーエステル化には向いていない例の一つ
塩基性のほうが安定な場合は、塩基条件下ハロゲン化アルキルでエステル化する方法や縮合剤を使う方法があります。
また、アルコールは大量に使ったほうが反応が進行しやすいのですが、アルコールが大切な原料である時はフィッシャーエステル化は向いていません。アルコール:カルボン酸=1:1で反応が進行するような方法、縮合剤を使った方法などが向いています(DCC/DMAP等)。
フィッシャーエステル化の利点
フィッシャーエステル化の利点はシンプルであること、大スケール反応にも適応できるところです。単純な構造をもつ原料化合物の合成ではフィッシャーエステル化は適しています。適応できる化合物に対しては高収率で得られることが多いです。
フィッシャーエステル化ではカルボン酸の酸で反応が進行しないの?
フィッシャーエステル化では酸触媒として硫酸などを加えますが、酸を加えなくてもカルボン酸の酸があれば触媒になるのでは?という疑問を持った人も多いと思います。
実はカルボン酸も同じく酸触媒として機能します。しかし酸性度の低さから反応に十分なプロトンが供給されないのが原因です。
実際に、酢酸とメタノールを加えて155℃に熱せれば反応時間が1時間程度でも半分量が酢酸メチルに変換されます。
実際に酸性度の高いトリフルオロ酢酸はエステル化の酸触媒としても使用されており、エステル化が進行します。
Paul W. Morgan,”Trifluoroacetic acid as a Esterification Catalyst” Ind. Eng. Chem.1951, 43, 11, 2575-2577
Johnston, Brian H., Anthony C. Knipe, and William E. Watts. “A kinetic study of the mechanisms of esterification of alcohols by trifluoroacetic acid.” Tetrahedron Letters 20.43 (1979): 4225-4226.
反応を効率よく早く進行させるためには酸性度の高い触媒を加えたほうが良いということです
フィッシャーエステル化が進行しない時
フィッシャーエステル化が進行しない時に注目すべき点を紹介します。
- 水が混入していないか?
カルボン酸やアルコールは吸湿しやすい物質なので、最初から水が混入している可能性があります。水をなるべく除くのが反応進行の鍵です。
- アルコールは十分な量入っているか?
アルコールは過剰量加えるのが基本です。入れられるのならば過剰に加えます。
- 熱は十分加えているか?
熱をかけて加熱還流が基本です。十分に熱を加えましょう。
- 脱水剤を加える
脱水剤としてMSや無水硫酸マグネシウムなどを使用することができます。
- 酸触媒を変更する
濃硫酸でアシリウムイオンを生成させて反応させる方法も酸に安定な化合物であれば利用できます。
古典的な手法としては硫酸が使われますが、取り扱いが難しかったりするので、有機溶媒に溶けやすく固体のp-トルエンスルホン酸がお勧めです。また、ルイス酸の三フッ化ホウ素エーテル錯体も温和でお勧めです。
フィッシャーエステル化の操作手順
フィッシャーエステル化はシンプルなため操作は簡単です。
メチル・エチルエステルなら
- カルボン酸を溶媒量のアルコールに加える。
- 冷却しながら触媒量の濃硫酸を滴下して加える
- 加熱還流
- エステルはたいてい特徴的な香りを有するので、反応と共ににおいの変化を観察またはTLCでカルボン酸の消失を確認
- 室温に冷却
- エバポレーターで大部分を濃縮 (生成物の沸点が低い場合は濃縮せずに蒸留する)
- 飽和炭酸水素ナトリウムを発泡がなくなるまで加えて(量によっては水酸化ナトリウムが良い)エーテルやジクロロメタンで分液または、冷却しながら水を加えて固体にしてろ過する
- 必要に応じてカラムクロマトグラフィーや再結晶で生成する。
塩化水素-メタノール、エタノールでのエステル化
カルボン酸の保護の意味でエステル化するときは、メチルやエチルエステルをよく使います。
メチルエステルやエチルエステルを作るときは塩化水素・メタノール及びエタノール溶液を使うのが簡便でマイルドです。
反応は至って単純でカルボン酸に溶媒量加えて混ぜるだけで3時間もしないでエステル化が完了します。
HCl-MeOHは販売されていますが、10%程度の塩化アセチルをアルコールに氷冷下で加えて調製することもできます(副生成物は酢酸メチルで低沸点のエステルが目的物でなければ問題にならない)。