生物が石や金属とは異なって動いたり、成長したりします。生物はなぜそのようなことができるのでしょうか?
生物の謎に大きくかかわっている物質があります。
それが「たんぱく質」です。
よく耳にする「DNA」や「遺伝子」も実は「たんぱく質の作り方」が書かれているものです。
それではたんぱく質とはいったいどのようなものでしょうか?
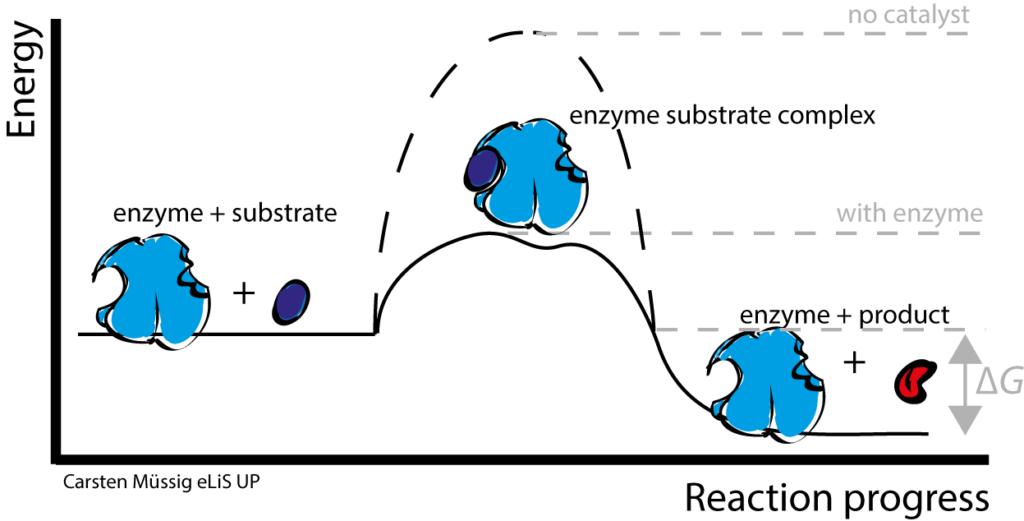
消化したり、エネルギーを作り出したり、細胞分裂したりしている中心にいるたんぱく質が「酵素」です。
本記事では酵素とは?どのような働きをしていてどのような種類があるのか?を紹介します。
酵素とは?
酵素はたんぱく質の一種!
酵素とは体内で起こる化学反応を助けるたんぱく質です。
体内で化学反応が起きているというと不思議な感覚を覚えるかもしれませんが、食べ物を消化したり、身長や髪の毛が伸びたりしているのも体の中で化学反応が起きている結果です。
例えば、お米はとても小さい細胞にとっては大きすぎるために、もっと小さい形に変換する必要があります。お米はでんぷんからできていますが、このでんぷんをもっと細かくすると「グルコース:ブドウ糖」という化学物質になります。まさにでんぷんからグルコースを作り出す過程で化学反応が起きており、その反応を起こりやすく触媒するのが酵素です。
なぜ酵素が必要なのか?
生体内で起こる化学反応を助ける酵素はなぜ必要なのでしょうか?それは、体内の環境は特定の化学反応を起こしにくい環境であるからです。例えば、化学反応は高温のほうが進行しやすいですが、体温は約37℃前後と低いです。また、私たちの体は水分でできていますが、水の反応性が高いため水中での化学反応は難しいです。塩基や酸の添加は化学反応を触媒するのに有効ですが、私たちの体内は中性に保たれています。金属も触媒として有用ですが、有害な金属は体内にたくさん蓄えていくのは難しいです。酵素は水中・中性・37℃という不利な環境でも化学反応が進行するよう助けています。また、酵素の中には化学反応の触媒に有用な金属(Fe, Cu Zn..)を活性中心に持ち活用しているものもあります。
実際の酵素を見てみましょう。下の図にあるものはたんぱく質分解酵素であるペプシンです。紫や青のひも・リボンのようなものが酵素・たんぱく質です。
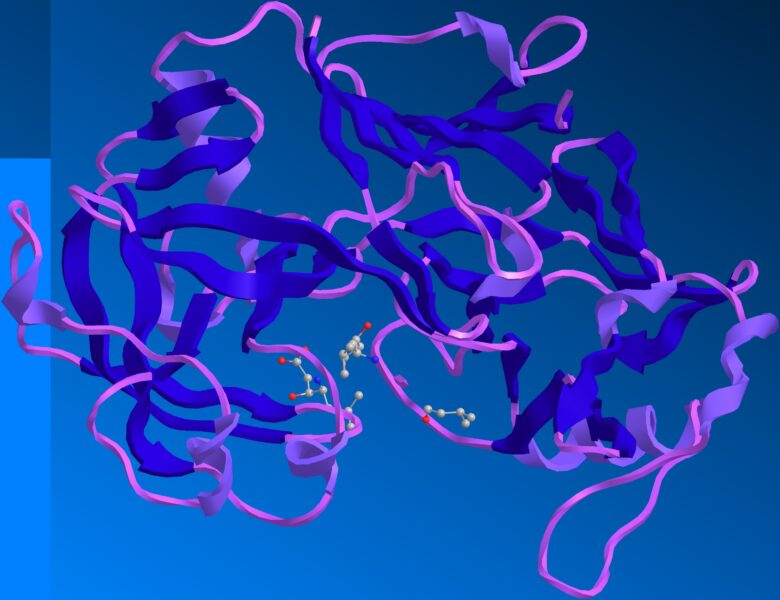
pepsine human 1)
見た目が化学物質っぽくないのは、酵素を見やすくする表記にしているためです。分子の形を見られるような表記に変えれば化学物質感が強くなります。灰色のボールは炭素、赤は酸素、青は窒素、黄色は硫黄原子を表しています。
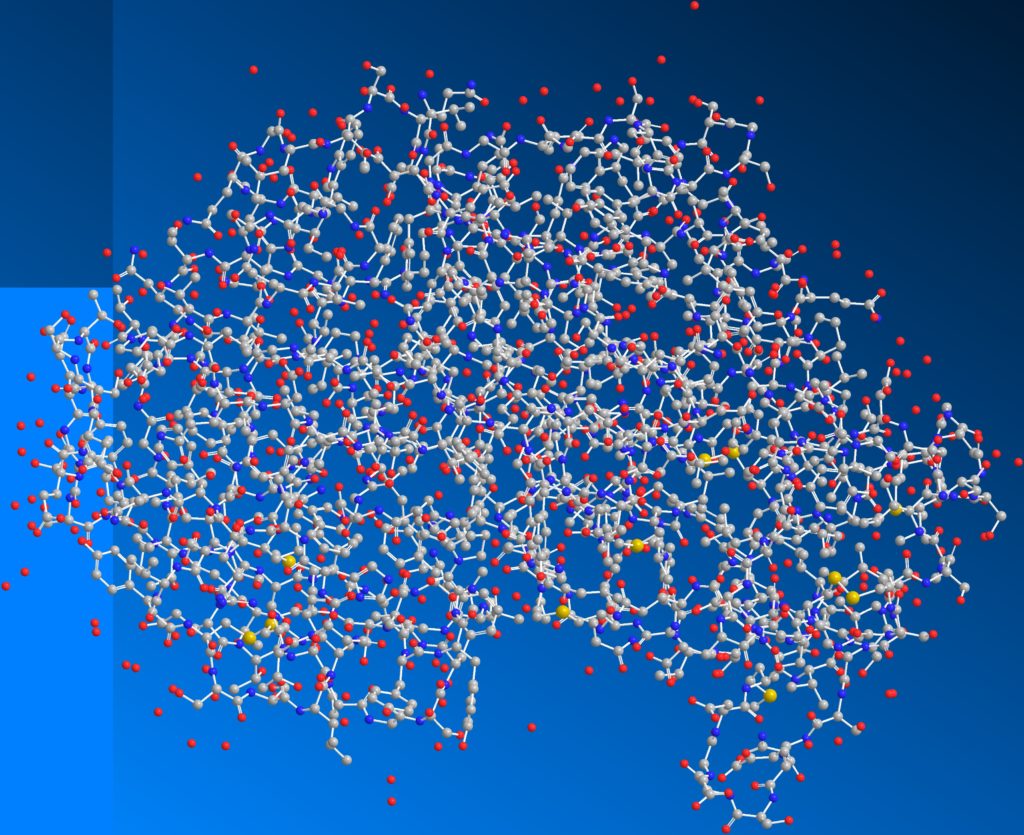
hepsin stickball
1) Fujinaga, Masao, et al. “Crystal structure of human pepsin and its complex with pepstatin.” Protein Science 4.5 (1995): 960-972.
こうしてみると酵素が巨大な分子であることが分かると思います。ちなみに酵素を含むたんぱく質はアミノ酸でできています。
酵素発見の歴史
一番最初に見つかった酵素は、1833年フランスのPayenとPersozによって麦芽から見つかったジアスターゼです(デンプンを糖に変換する酵素)。ジアスターゼはアミラーゼとも言います。
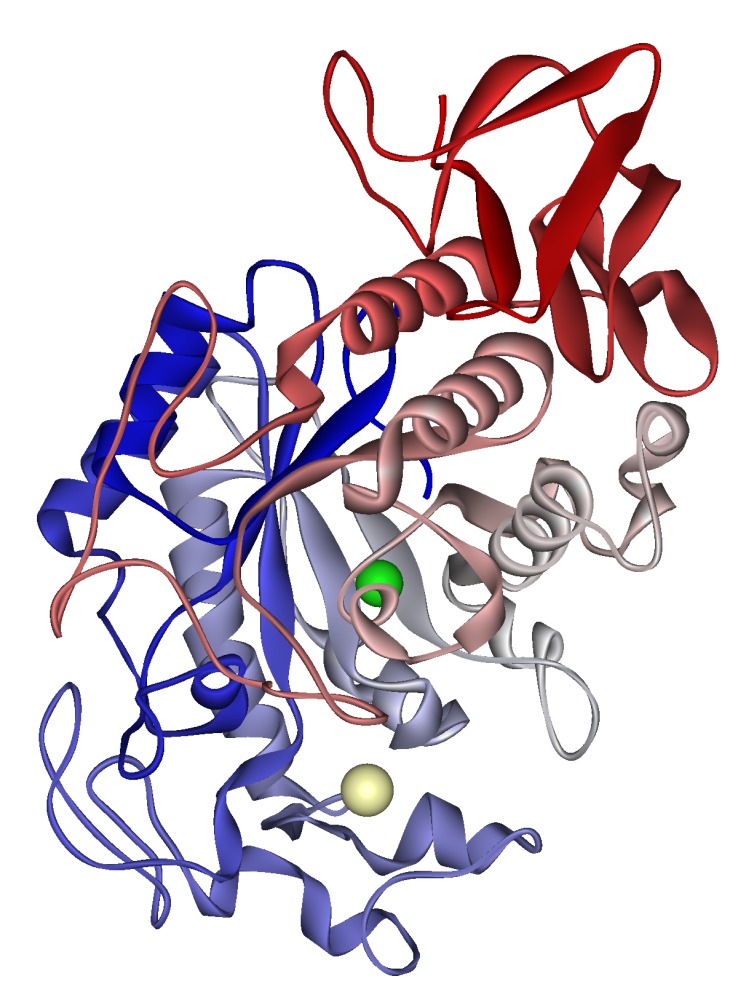
α-アミラーゼの立体構造 PD
それ以降の研究で1940年代にNorthropによってペプシンなどの単離精製が成功し、酵素がタンパク質であるということが認められるようになりました。
酵素の働きとは?
酵素はどのように働いているのでしょうか?それを理解するには酵素を分子のレベルで観察していく必要があります。
酵素は様々な化学反応を触媒しています。それらの化学反応を起こしやすくしたり、特定の分子のみで起こるようにしているのが酵素ですが、どのような仕組みで酵素反応を行っているのでしょうか?
酵素が大きい分子であることを説明しましたが、実は酵素の大部分は使われていないといってもよいです。酵素反応の多くは表面がくぼんだ特定の部位で起こっています。そういった部分を「活性中心」といいます。酵素の活性中心(active site)とは「酵素反応がまさに行われる部分」です。

酵素によって反応が起こされる側の分子を「基質:substrate」といいます。酵素は基質を別の分子に変換する反応を助けます。また、酵素は「カギと鍵穴」の関係に例えられるように、酵素は特定の決まった分子の反応のみを触媒する「基質特異性」があります。
酵素反応のメカニズム
酵素反応がどのようにして起こるのかをもっと詳しく見ていきましょう。
先ほど登場したたんぱく質を分解する酵素であるペプシンの反応を例に考えていきます。
たんぱく質はアミド結合という結合を介してつながっています。
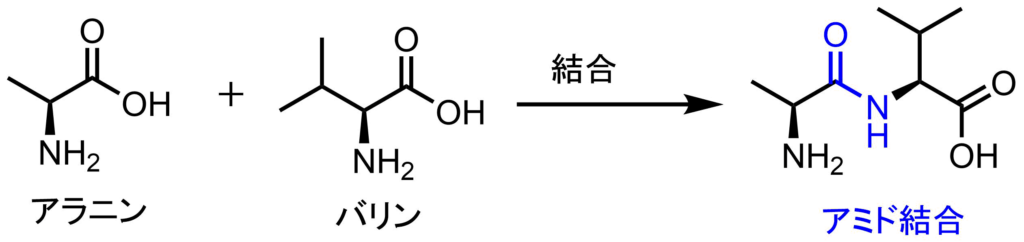
アミド結合の形成
このアミド結合を分解する酵素がペプシンです。ペプシンは酵素の中では基質選択性が低く、様々な基質を分解します。
ペプシンの酵素活性中心でアミド結合の分解に役立っているのは酵素のアスパラギン酸2分子と水分子です(アミド結合の分解は加水分解反応)。化学的に見るとアミド結合の分解は酸触媒下で良く進行します。酵素中でもアスパラギン酸のカルボン酸が酸触媒となって、アミドの酸素を活性化して加水分解を触媒しています。酵素の反応前後の構造をみると同じ状態に戻っています。このように触媒は反応前後で自身は変化しません。
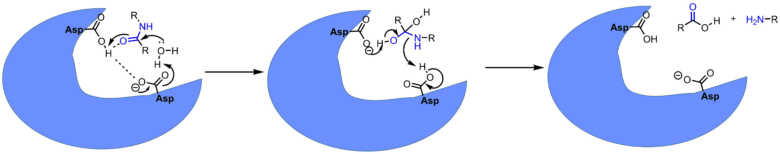
ペプシンによる酵素反応の機構
活性中心で活躍するアミノ酸側鎖官能基
酵素活性中心で基質に対して相互作用するのは主に極性アミノ酸側鎖です。
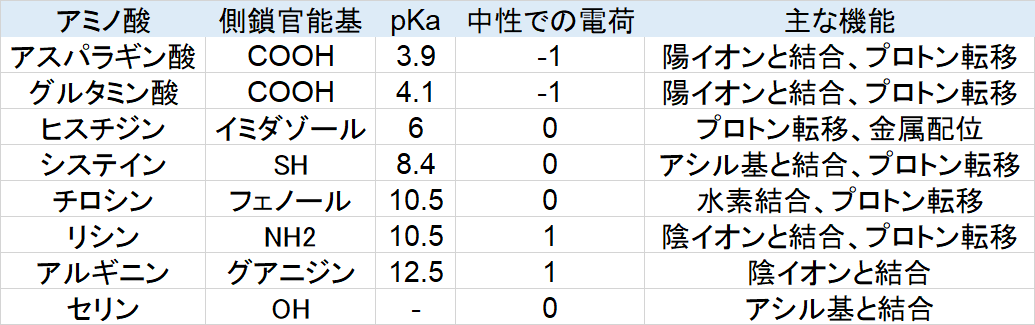
表中では極性アミノ酸の官能基のpKaが低い順(酸性度が大きい順)で並べたものです。電荷とは、生体内中性条件で、側鎖官能基の脱プロトン、プロトン付加によって、電荷を帯びるているかどうかを示しています。セリンのアルコール性ヒドロキシ基は中性に近いため省いています。
例えばアスパラギン酸は中性条件ではカルボン酸の水素が外れやすく、負電荷を帯びていると想定します。この側鎖の近くに第四級アンモニウムカチオンが近づいてきたら、カルボキシラートアニオンとイオン結合をするだろうということです。このように各アミノ酸側鎖の種類によって相互作用の仕方は変化します。