電気陰性度は原子の性質や反応性を考える上で非常に重要です。
電気陰性度は文字通り「電気的にマイナスになる度合い」です。元素によって電子を奪って陰イオンになりやすさは変化します。フッ素は最も電気陰性度が高く電子を奪って閉殻して希ガスのネオンと同じ電子配置になって安定化します。
化学反応は電子の移動によって起こるので、どの原子が電子をひきつけやすいのか?を知っておくと化学反応を予測することができるようになります。
今回の記事では電気陰性度について詳しく解説していきます。
電気陰性度とは?
電気陰性度は「原子が自身の電子をひきつける強さ」を表します。
この電子をひきつける強さ・電気陰性度は元素によって違います。
なぜ電気陰性度が元素によって違うのかを説明していきます。
原子の構造と電荷
まずは、原子の基本から復習していきます。
原子は「陽子」「中性子」「電子」3つからできています。
重要なことは
- 陽子がプラス+
- 電子がマイナスー
- 中性子は電荷0
であることです。異種の電荷同士は互いに引き合います。電子は陽子にひきつけられています。
水素と炭素の原子の構造が下の画像です。原子番号1の水素は電子1、中性子1で例外的に中性子を持っていません。一方で炭素は原子番号6で電子を6個、陽子を6個、中性子を6個持っています。
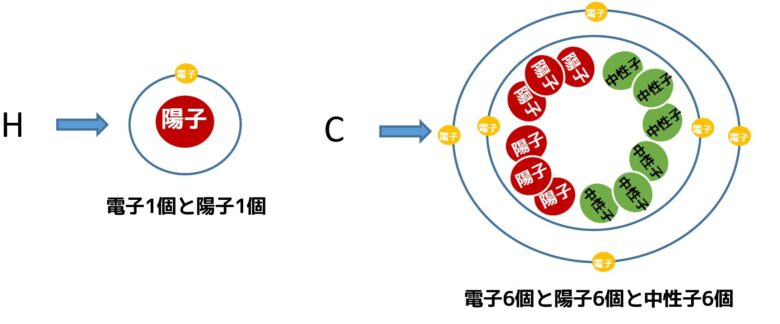
原子の構成
水素と炭素はプラス?マイナス?でしょうか?
- 水素は電子が1つで電荷「-1」陽子が1で電荷「+1」→総和±0
- 炭素は電子が6つで電荷「-6」陽子が6で電荷「+6」→総和±0
したがって、水素と炭素は電気的に中性です。プラスでもマイナスでもないです。
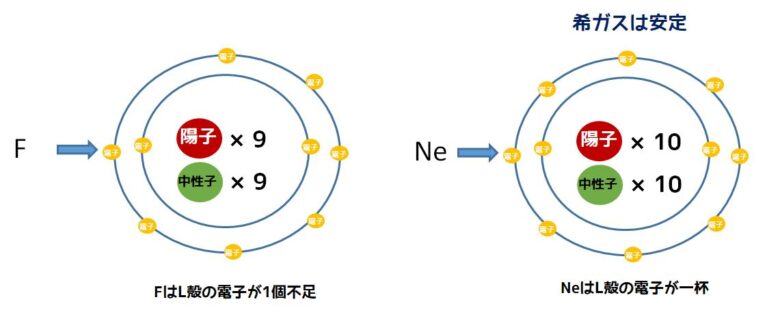
それではフッ素(F)とネオン(Ne)ではどうでしょうか?下の画像はフッ素とネオン原子の構造を示したものです。
フッ素は原子番号9番目で電気的に中性です。ネオンは原子番号10番目で中性です。このネオンは希ガスと呼ばれており、化学的に非常に安定です。
それではなぜ安定なのでしょうか?これは、電子が入ることのできる部屋が満杯な状態のことを示す「閉殻」の状態だからです。
閉殻による安定化
フッ素はL殻の電子が1個不足しているため、閉殻ではありません。化学的に安定になるためにフッ素は1個の電子が必要です。ですから、外から電子を1つ奪いたいという状況になっています。
フッ素は安定になるために電子を強く引き付けています。実際にフッ素は電子を奪ってフッ化物イオンになってネオンと同じ電子配置(閉殻)して安定化します。フッ素の電気陰性度が高いのは電子一つを得て閉殻安定化する力が働くからです。フッ素は全元素の中で最も電気陰性度が高い元素です。
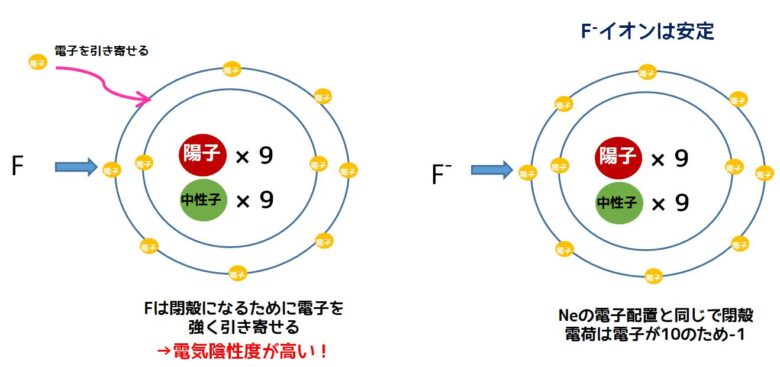
フッ素の閉殻
電気陰性度が高い元素は電子を奪って閉殻できる元素です。周期表の17族や16族あたりが電気陰性度が高いです。原子番号3番のリチウムは電子を一つ失うとヘリウムと同じ電子配置になって閉殻します(イオン化エネルギーが小さいです)。
Sandbh [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)]面白いことに、フッ素の次に電気陰性度が高いのは酸素で次が窒素です。塩素はその次です。17族の元素はどれも一電子失うと閉殻して安定化するはずですが、周期表の下に行くにつれて電気陰性度が低下します。なぜでしょうか?
これはプラス電荷をもつ陽子(原子核)との距離が影響しています。フッ素と比べると塩素は電子が入る最外殻電子殻(M殻)と電子核間の距離が長いです。そもそも電子をひきつける力は電子核にある陽子のプラス電荷にあるため、距離が遠くなると電子をひきつける力は減少します。
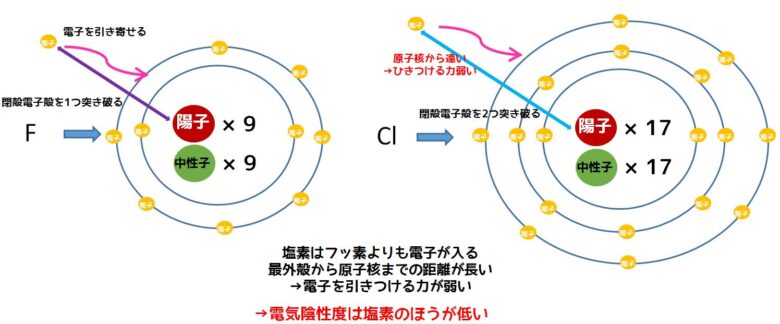
塩素のほうが電気陰性度が低い理由
そのため、電気陰性度の順番がF>O>N≒Clというように原子番号が小さく希ガスに近い側の元の電気陰性度が高くなっています。
以下の説明は細かい説明で大学レベルのものも含みます。興味のある人は読んでみてください。
陽子と電子を二つの点電荷(正電荷と負電荷)とします。この2つの電荷の間の距離をr、電荷量をそれぞれq1, q2、比例定数kとした時、二つの電荷間に生じる引力Fはクーロンの法則より導かれます。
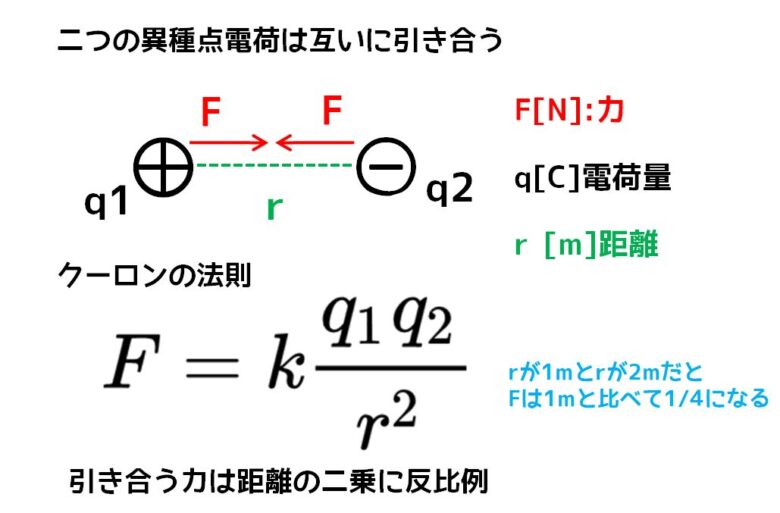
クーロン力と電荷の力
この式を見てわかる通り、力は距離の二乗に反比例します。これはつまり距離rが1mと2mでは22=4となり、1mの時と比べて2mではFが1/4になることを示しています。したがって、原子核と電子との距離による減衰は非常に大きなものになります。
有効核電荷とは最外殻の電子が感じる原子核の電荷のことを意味します。「有効」という意味は本来あるはずの核電荷(陽子のプラス電荷)を感じないパターンがあることを暗に意味しています。
実際に核電荷は核遮蔽という現象によって電子が感じる電荷が減少します。
核遮蔽は電子殻の図を見ると理解しやすいです。

フッ素と塩素では核遮蔽の度合いが違う
電子の数が増えてると原子核周辺は電子に覆われるようになります。つまり電子が増えれば増えるほど原子核は負電荷を帯びた電子のベールに覆われる形になります。これが核遮蔽の原因です。有効核電荷は、
有効核電荷= (本来の核電荷)ー(遮蔽定数S)
であらわされます。遮蔽定数はスレーター則により近似的に求めることができます。
参考 スレーター則 - Wikipedia取得できませんでした| 元素 | 有効核電荷 |
| H | 1.0 |
| He | 1.7 |
| Li | 1.3 |
| Be | 2.0 |
| B | 2.6 |
| C | 3.3 |
| N | 3.9 |
| O | 4.6 |
| F | 5.2 |
| Ne | 5.9 |
s < p < dの順に遮蔽が効きやすくなります。
電子殻と主量子数の関係
| 電子殻 | 主量子数 | 収納できる電子 | 軌道 |
| K | 1 | 2 | s |
| L | 2 | 8 | s+p |
| M | 3 | 18 | s+p+d |
| N | 4 | 32 | s+p+d+f |
| O | 5 | 50 | s+p+d+f+g |
| P | 6 | 72 | s+p+d+f+g+h |
電子殻の概念と量子数の関係です。
電気陰性度の覚えかた
電気陰性度は非常に重要なため記憶しておくとよいです。上の説明のように原理が分かっていれば、そんなに覚えるのは苦労しないと思いますが、一応語呂合わせのようなものがあります。
そのまま英単語のようにするとFONCl BrCHのようになります。炭素と水素は有機化学で出てくるので無理やり入りこんできます。
語呂合わせには「フォン狂っちゃう F O N Cl CH」とか「フォン黒豚ちゃん F O N Cl Br CH」とかあります。
電気陰性度の算出の仕方によって若干順番が入れ替われります。
- ポーリングの電気陰性度 ( Cl 3.16 > N 3.04)
- アレンの電気陰性度 (N 3.07 > Cl 2.87)。
なので、N≒Clというような感じで扱われています。
電気陰性度と分極、極性
電気陰性度が重要なのは、電気陰性度が高い分子と結合すると原子間で共有した電子が陰性原子のほうに引き寄せられる現象(分極)がみられることです。
これがあまりにも強くなるとちぎれてイオンになります(NaOH)
イオンは反応性が高く、例えばH+とHO-の中和反応は一瞬で進行します。
イオンほど行かなくてもいつ切れてもおかしくないようなほど分極した分子はイオンと同じように反応性が高いです。このような分子は様々な化学反応に利用されます。
炭素同士は同じ電気陰性度なので分極は生じません。H-ClはH+を生じることから極めてイオンに近く、電子は塩素に引っ張られて塩素側に分極しています。NaOHまで行くと電気陽性なNaと電気陰性な酸素の組み合わせのため、OHが電子を奪ってイオンになります。
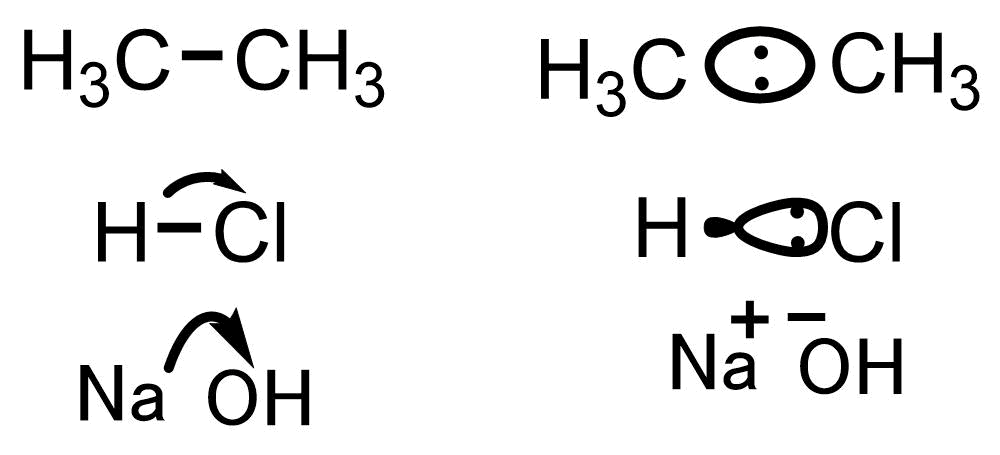
分極の様子 Pauling電気陰性度:Na 0.93, H 2.20, C 2.55, Cl 3.16, O 3.44
極性分子とは一般的に電気陰性度の高い分子が結合することによって分極が生じた分子やイオンなどをさします。水やアンモニア、アルコールなどは電気陰性度の高い酸素や窒素を含むため電子が引っ張られて分極しており、極性の高い分子です。
分極と反応性
化学反応の中心は極性反応といって、電気的に陰性な分子(電子が豊富な分子)から電気的に陽性な分子(電子が不足している分子)に対する電子の移動によって起こることが多いです。
例えば、エチルクロリドと水酸化ナトリウムの反応を考えてみましょう。塩素は電気陰性度の高い元素であるため炭素の電子を引っ張って分極しています。分極はδ+やδ–などと表すことが多いです。つまり塩素の隣についた炭素はプラスに分極しているので電子を失いやすいです。そこに電子豊富で反応性の高い水酸化物イオンがぶつかってくる(攻撃される)と、塩素との結合を切って入れ替わります。
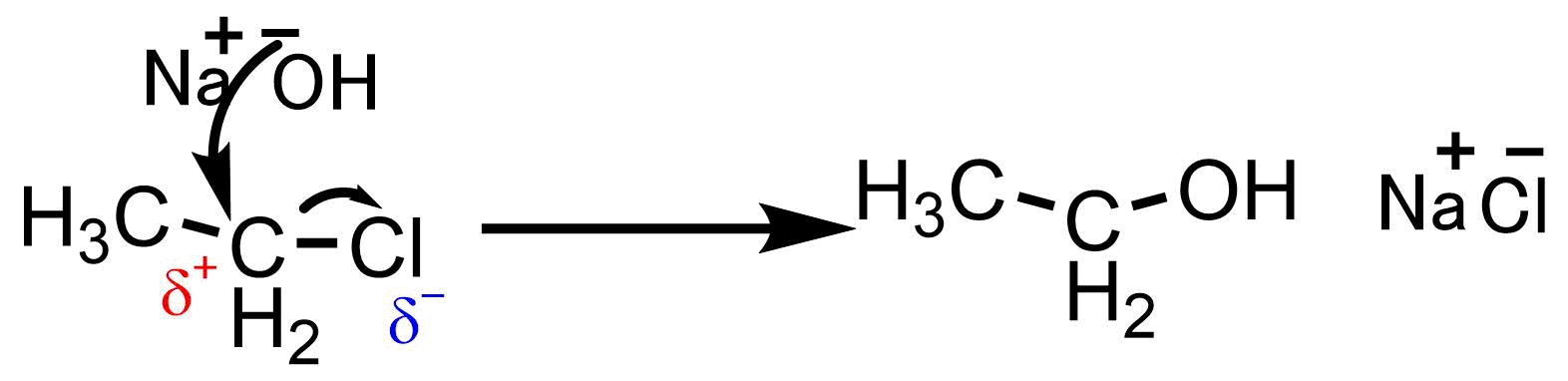
分極した分子が反応する理由
反応によってエタノールと塩化ナトリウムが生成しました。有機化学反応は大体こんな感じで進行してきます。
電子親和力
電子親和力は電気陰性度とごっちゃになりやすいかもしれません。電子親和力原子に電子1つを与えたときに放出・吸収されるエネルギーのことです。
電子を与えてエネルギーを放出するということは、電子を得ることによって安定になる原子です。つまり、電子を欲しがっているフッ素などの電気陰性度の高い原子は大きなエネルギーを放出します。
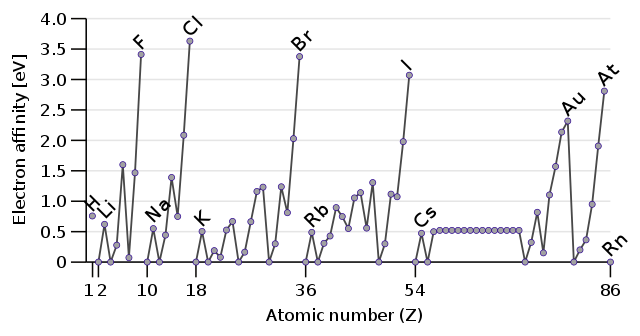
電子親和力 from wikipedia DePiepBahasa Indonesia: Agung Karjono [CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)]



