目次
非局在化とは?
非局在化とは「一部の場所にとどまらない」という意味です。
「電子が非局在化するため安定性が高い」という説明は、「非局在化」を理解していないと意味不明でしょう。
化学において非局在化とは「電子が一つの原子にとどまらずに分子全体に分布する」ことを意味します。
熱湯を入れたコップの熱が周囲に広がってやがて冷めるように、電子も一つの場所にとどまらずに分散しようとします。
局在化する電子
実際に電子の動きに着目して見ましょう。
下図のようにアルコールのヒドロキシ基(OH)は電子を奪いやすい酸素と電子を与えやすい水素が結合しています。
例えばアルコールを2つのイオンに分けるとすると、酸素が水素から電子を一つ奪ってマイナスのアルコキシドイオンになります。
このマイナスイオン(電子)は電気陰性な酸素原子上から他の炭素原子上に移動したりはせずに酸素原子上にとどまる → 酸素原子に局在化します。(酸素上の電子は同じ分子内の炭素原子上に移動ができない)
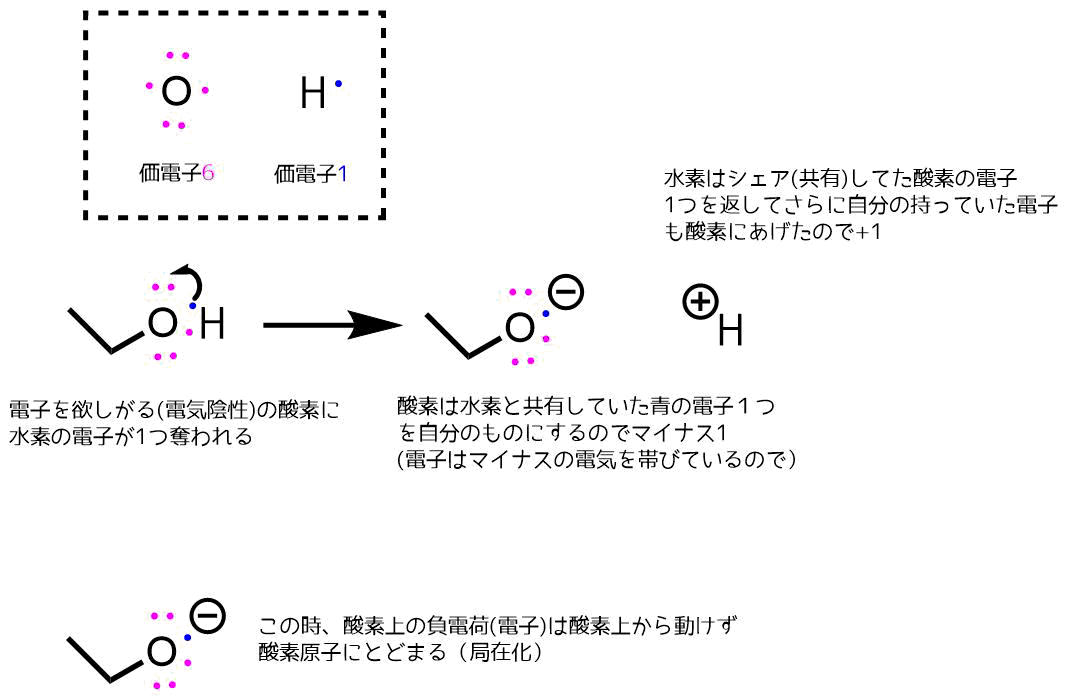
局在化する電子
電子は他の原子に電子を与えて分散化したいのに酸素原子上という一箇所にとどまる(熱が周囲に分散しないのをイメージ)ために非常に攻撃的です。こうした一箇所にとどまるようなマイナスイオン(アニオン)は不安定で反応性が高い強塩基です。
同じアニオンでもどれが強塩基?
強塩基の-OHの酸素は電気陰性度が高いため電子を引き寄せてマイナスになりやすい原子です。
他にも-NH2 アミドイオンや-Cカルバニオンは酸素よりも電気陰性度が低くマイナスになりにくい原子です。そのため、酸素と比べて電子を別の原子に渡して±0になろうとします。つまりより不安定なアニオンといえます。
酸素よりもずっと電気的に陽性な炭素アニオンは非常に不安定で、ブチルリチウムなどのずっと強い強塩基です(ブチルリチウム等)。

他の原子上に局在化する電子
非局在化で安定化する理由
電子が一箇所の原子に局在化しているために、他の原子に電子を与えようとする力が強くなります。
逆に電子が一箇所の原子に局在化するのではなく、分子内の他の原子に渡すことができたら他の分子に電子を渡さずに済むかもしれません。
酸素の原子で背負っていた(局在化)電子の負のエネルギー(100%)を分子内の7つの原子で分散できれば一つの原子あたりの電子の負のエネルギーは1/7 (約14%)になります。
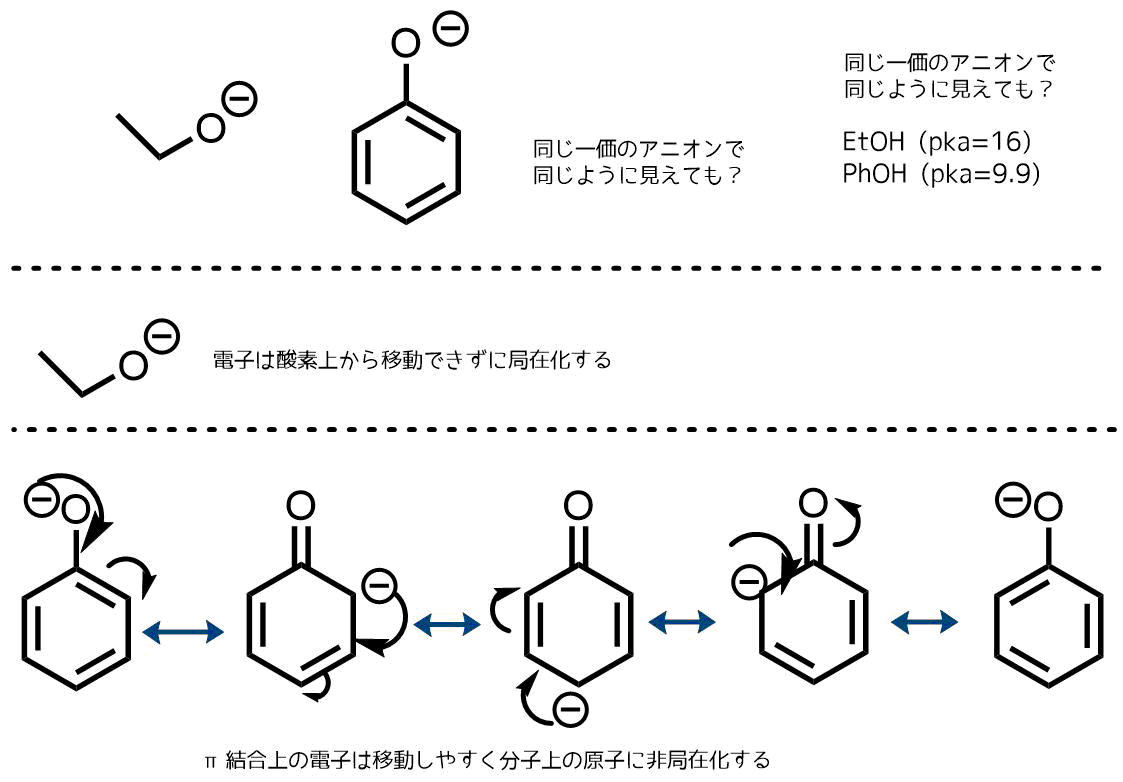
非局在化する電子の様子と塩基性・酸性性
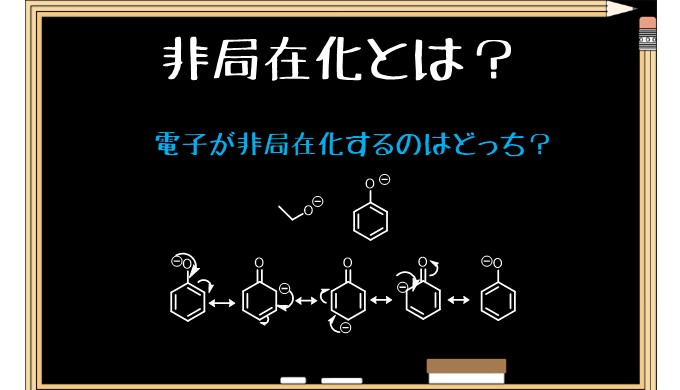
エタノールよりもフェノールのほうがアニオンになったときに分子内で電子が非局在化するのでより安定に存在できます。逆に言えばH+を放出して自らがマイナスになっても良いといえます。エタノールは-になっても他の原子にマイナス分を分け合えないので不安定なため、H+を放出したくはありません。
つまり、H+の放出のしやすさはアニオンの安定性に関係があるということになります。フェノールはエタノールよりもH+が外れた時のアニオン(共役塩基)が安定なため、H+を放出しやすく、より酸性度が高いです。pKaをみるとフェノールは9.9と弱酸性ですが、エタノールは16と中性です。
逆にエトキシドはフェノキシドと比べて強塩基です。
非局在化は重要!
酸と塩基性を考えるうえでも、反応を考えるうえでも電子の非局在化は重要です。
共役、共鳴といった言葉も登場するので合わせて抑えておきましょう。
芳香族化合物が高い安定性をもつ秘密が「電子の非局在化」にあります。