- エステル化、アミド化、チオエステル化、カルバメート化に使用!
- アミド化に利用することも多いがラセミ化するのでペプチド合成には不向き
- 意外と少ないエステル化試薬の一つ
CDIとは?
CDI(カルボニルジイミダゾール)は縮合剤でアミド化やエステル化に利用します。
CDIはカルボン酸の活性化試薬の一種でカルボン酸と反応して脱離しにくいOH基と置換することでアミン(NH2)やアルコール(R-OH)などと置換しやすくします。
1848年に発見された歴史ある試薬です。
アシルイミダゾールの生成
CDIはカルボン酸と反応して反応性の高い中間体・アシルイミダゾールを生成します。
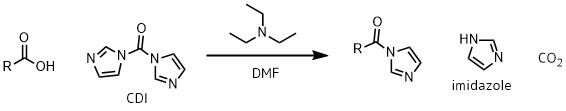
アシルイミダゾールの生成
CDIとカルボン酸との反応は素早く、1時間程度で進行します。
生成したアシルイミダゾール体にアミンを加えるとアミドが速やかに生成します。
求核剤にアルコールを使えばエステル、チオールではチオエステルが得られます。
基質をカルボン酸の代わりにアミンを用いた場合、さらにアミンと反応させればウレア、アルコールではカルバメートを合成することができます。
アシルイミダゾール生成の反応機構
カルボン酸がCDIのカルボニル炭素へ求核攻撃して生成した酸無水物に副生したイミダゾールが攻撃して脱炭酸を伴ってイミダゾールとアシルイミダゾールが生成します(経路A)。
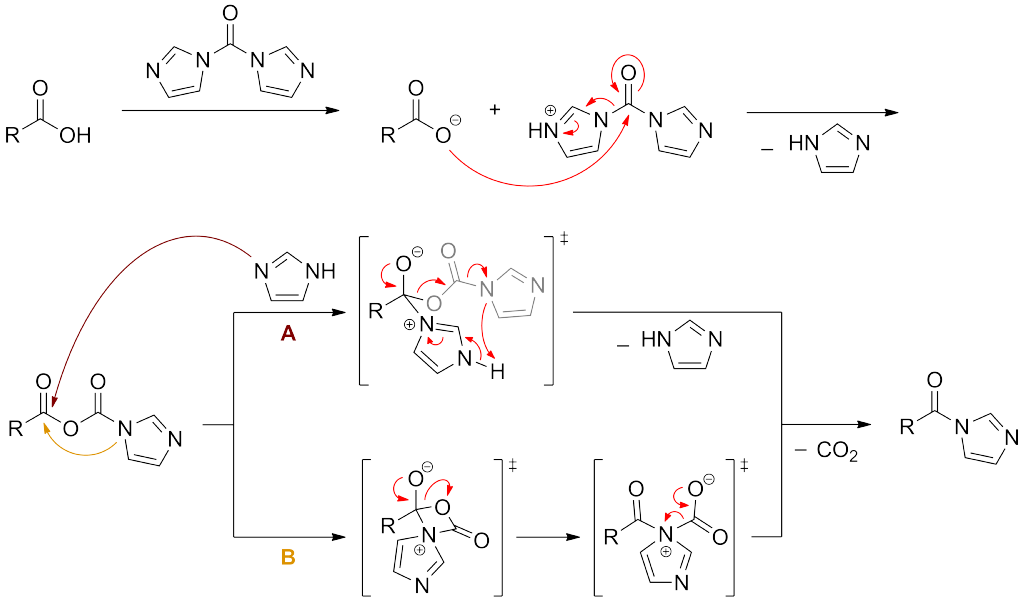
アシルイミダゾール生成の反応機構 by wikipedia, Rb.fre [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)]
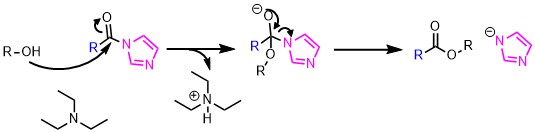
CDIによるエステル化反応機構
CDIの特徴とは?
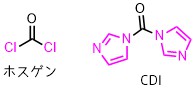
CDIと似た試薬としてホスゲンがあります。
ホスゲンはCDIのイミダゾールが塩素に置換した分子です。
ホスゲンは液体で反応性高く扱いにくい欠点がありますが、CDIは固体でホスゲンほど反応性が高くないため扱いやすい利点があります。
CDIの利点をまとめました。
- 大スケール適用可(良反応性、塩基フリー)
- 副生物は水洗除去可能(イミダゾール)
- 反応性は酸塩化物に匹敵
- 反応が速い
CDIの反応例と選択のポイント
CDIとアミンを予め混合してN-アシルイミダゾールとした後にカルボン酸を加えてアミド化することで、塩基フリーでしかも大スケールでジペプチドを合成した論文がでています(de Figueiredo, Renata Marcia, et al. “Sequential One‐Pot Synthesis of Dipeptides through the Transient Formation of CDI‐N‐Protected α‐Aminoesters.” Advanced Synthesis & Catalysis 359.11 (2017): 1963-1968.)
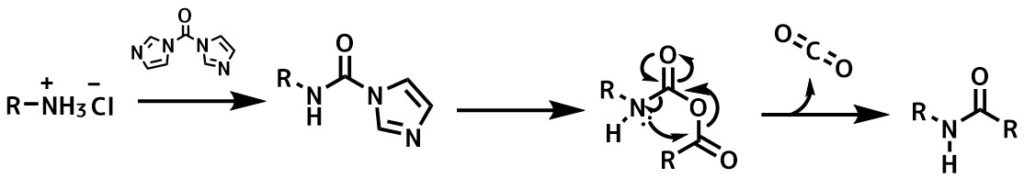
CDIのアミン活性化機構ー通常はカルボン酸を活性化するが、アミンを加えてアシルイミダゾールとした後にカルボン酸を加えるとカルバミン酸無水物を形成し脱炭酸を伴って転位してアミドが生成します。アミンは塩酸塩でも塩基フリーでOKなのが利点。ラセミ化も少ない。塩酸によるイミダゾールの活性化が行われていると考えられる。0.5eqCDI in DCM, amine1.5eq, 30min after added CO2H 1.0eq at rt wash 1M HCl for workup
副生成物はイミダゾールと二酸化炭素なので、薄い酸性水溶液で洗浄すれば副生成物は除去可能なのは嬉しいポイント。後処理が容易かつ比較的安価なものはCDIの他にEDCと酸クロライドがあります。
個人的にはアミド合成ではCDIよりもEDC/DMAPかHOBtのほうが知見も多く好みです。
CDIとアミン、MeIとの反応によって生成するNメチルイミダゾール誘導体は第三級アミドの合成に適しています。
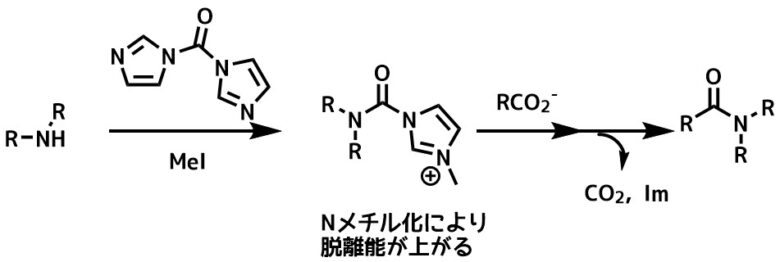
酸塩化物の合成が難しい分子やラセミ化が問題にならない分子の場合には試してみると良いかもしれません。
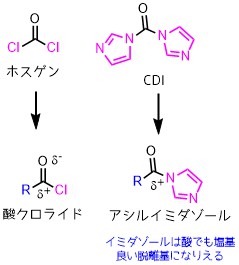
酸クロライドとアシルイミダゾールは類似している
CDIの欠点
扱いやすく様々な縮合反応に使える万能試薬であるが故にCDIでなければならない条件は少ないかもしれません。
安価さと反応性ではカルボン酸を酸塩化物とする方法が抜きん出ています。
アミド化に関しては特にペプチド合成では多くの専用の合成法があるので利用されることは少ないです。
また、酸塩化物では反応性が高すぎる、あるいは酸塩化物にできない基質で安価かつちょうど良い反応性の試薬といえば反応例も多いEDCIに軍配が上がる気がします。
対称、非対称なウレアやカルバメートの合成には向いているとおもいます。
ざっと欠点を挙げると
- ラセミ化が起こりやすい
- 芳香族アミンのアミド化は進行が遅い
芳香族アミドのほか、エステル化はアミド化と比べて起こりにくく、通常は70℃程度の加熱が必要です。
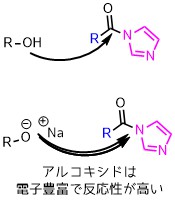
アルコキシドで反応性を上げる
アルコールよりも求核性が高いアルコキシドを使えばより低温で反応させることも可能です。
CDIに関する論文
二酸化炭素添加でアミド化が加速する
CDIを使ったアミド合成がキログラムスケールで反応が遅くなった原因が反応容器中の二酸化炭素放出が不十分だったことによるアミン炭酸塩生成だと考えたが、逆に二酸化炭素が反応を加速していたことを発見した論文が報告されました。
反応THF溶液中にCO2をバブリングすると2~20倍ほど50%変換時間が早くなります。ミリモルスケールで試しています。
Vaidyanathan, Rajappa, et al. “Amidations Using N, N ‘-Carbonyldiimidazole: Remarkable Rate Enhancement by Carbon Dioxide.” The Journal of organic chemistry 69.7 (2004): 2565-2568.
塩酸の添加は反応性の低い芳香族アミンとのアミド化に有効
二酸化炭素の吹き込みで反応性が上がるといえば思いつくのが炭酸。溶液の酸性度が上がれば反応が速くなりそうと想像できますが実際に酸を加えると良いそうです。
通常は遅い芳香族アミンのCDIによるアミド化が、酸を加えることで早く進行することが報告されています。平均で20倍早くなるようです。酸触媒として、イミダゾール塩酸塩を1..5eq加えて反応させます。
アシルイミダゾール中間体の構造を見れば酸を添加が有効な理由がわかります。
Woodman, Emily K., et al. “N, N′-Carbonyldiimidazole-Mediated Amide Coupling: Significant Rate Enhancement Achieved by Acid Catalysis with Imidazole· HCl.” Organic Process Research & Development 13.1 (2008): 106-113.
CDIを使ったアミド化反応
第三級のアミド合成にCDIは有効です。
第三級アミドは下記の構造のようにピペリジンやピペラジンのような環状脂肪族アミンをリンカーとしてユニット同士を連結するという場合に生じます。直鎖構造と比べて構造がカチッとするとので医薬品などの機能性分子に向いています。
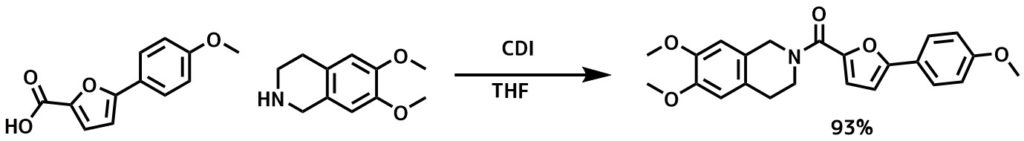
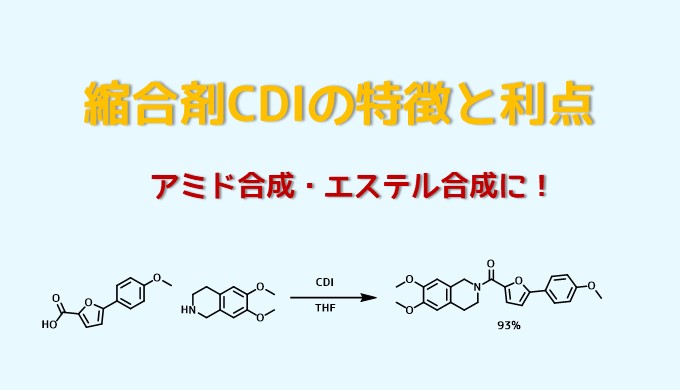
CDIのアミド化反応条件ー Capparelli, Elena et al Journal of Medicinal Chemistry, 57(23), 9983-9994; 2014
乾燥THF中にカルボン酸(1mmol)と1,1′-カルボニルジイミダゾール(1.1mmol)の混合物を室温で一晩撹拌した。乾燥THF中のアミン(1 mmol)の溶液を反応混合物に加えて室温で4時間撹拌した。分液、カラム精製により目的物を93%の収率で得た。
不安定な構造や合成終盤ではカルボン酸の塩素化は反応がうまくいかなかった時に副反応により回収できない別の分子に変わるのは避けたいところ… そんな時はもっと穏やかな反応剤が適しています。
アシルイミダゾールを使った膜たんぱく質修飾反応
話が脱線しますが、アシルイミダゾール構造を応用したたんぱく質修飾反応を紹介します。
アシルイミダゾール構造は酸クロライドに匹敵する反応性の高さを持ちながら安定で単離でき、立体障害も他のものと比べて小さいことに着目し、これを膜タンパク質のリガンドに組み込むことによって膜表面上に存在する求核性アミノ酸(リシン)のアミノ基と反応させて蛍光ラベル化に応用しています。
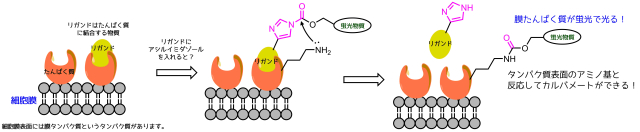
アシルイミダゾールの応用
タンパク質表面にはリシンなどの反応性の高いアミノ基を持つアミノ酸が存在する可能性があります。リガンドがタンパク質と結合することで、アシルイミダゾールと反応性基(アミン)が接近することで反応がより進行しやすくなります。触媒みたいですね。
Fujishima, Sho-hei, et al. “Ligand-directed acyl imidazole chemistry for labeling of membrane-bound proteins on live cells.” Journal of the American Chemical Society 134.9 (2012): 3961-3964.
参考文献
アシルイミダゾールの反応については以下の論文
1)太田俊作, and 岡本正夫. “合成化学における 1‐Acylimidazole の新しい利用.” 有機合成化学協会誌 41.1 (1983): 38-50.