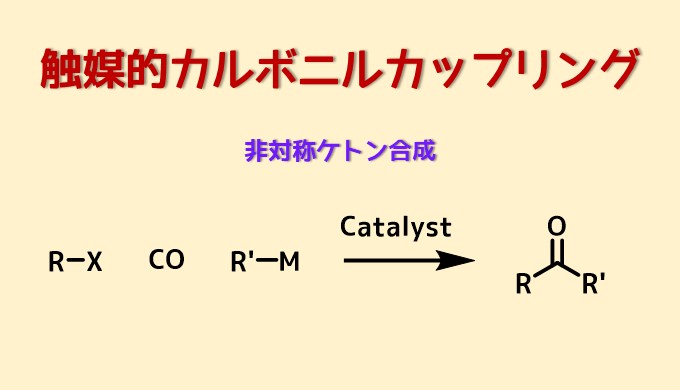
触媒的カルボニルカップリング反応は一酸化炭素を利用してハロゲン化アリールと有機金属化合物を結合させてケトンを合成する方法です。
マイルドな条件で進行することが多くケトン合成の強力な手段となりえます。一方で有毒気体の一酸化炭素を使用するのが欠点ですが、近年一酸化炭素を使用しなくても良い条件が報告されており、さらに有用性が高くなっています。
触媒的カルボニルカップリング反応とは?
非対称な芳香族ケトンなどの合成方法といえばフリーデルクラフツ・アシル化反応がありますが、塩化アルミニウムなどの強力なルイス酸触媒を要する欠点があります。
有機リチウム試薬やグリニャール試薬を利用した方法もありますが、試薬の反応性や塩基性などが問題です。
触媒的カルボニルカップリング反応はその他のクロスカップリング反応のようにアリールハライドを基質として、有機ホウ素化合物や有機スズ化合物などの様々な有機金属化合物と一酸化炭素の三成分のカップリングを利用した方法です。
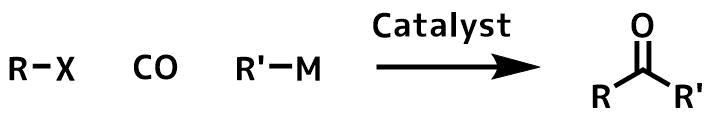
触媒的カルボニルカップリングの概要
最近は気体の一酸化炭素を使用しなくてもカップリングが可能な条件も報告されています。
Stileカップリングや鈴木宮浦カップリングなどがよく利用されていて、エステルやアルデヒドなどが存在していても反応が進行するなど選択性の高さが利点です。
鈴木宮浦カップリング反応
鈴木宮浦カップリング反応はアリールハライドと有機ホウ素化合物との触媒的カップリング反応ですが、一酸化炭素を加えることによってカルボニルカップリングも可能です。
Dr. Xinxin Qiらはギ酸を一酸化炭素源としたパラジウム触媒カルボニル鈴木宮浦カップリング反応を2015年に報告しています。
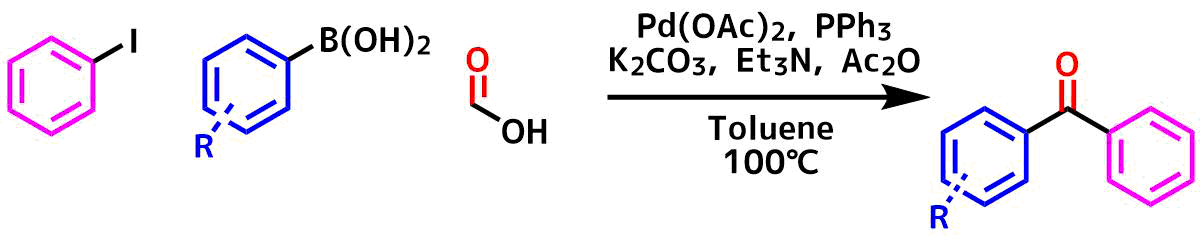
カルボニル鈴木宮浦カップリング反応
臭化アリールよりもヨードアリールのほうが収率が良く、リガンドもPPh3が顕著に収率が良かったようです。
収率が低くなる条件は
- オルト置換体 [O-OMe(30%), p-OMe(83%)]
- 電子求引基 (p-F(36%),p-Ac(23%), p-NO2(41%)
となっています。
オルト置換体の収率が低下するのはよくあることで、立体障害などが原因であると考えられます。電子求引基はニトロよりもアセチル基(アルデヒドも)がのほうが低いのは副反応が起こってしまうからでしょうか?
いずれにしても、COを使わないで様々な基質で進行することから非常に有用な方法であると考えられますさらなる最適化でより有用性が向上しそうですね。
一般的な操作法
Pd(OAc)2(3mol%)とPPh3(6mol%)を加えて窒素置換し、トルエン(6.0mL)、ハロゲン化アリール(1.0mmol)、アリールボロン酸(1.2mmol)、K2CO3(3mmol)、およびEt3N(4mmol)を加えて最後にギ酸(3.0mmol)と無水酢酸(3.0mmol)の混合物を滴下して加えて、30℃で1.5時間攪拌し、その後100℃で10〜12時間撹拌した。濾過、濃縮してカラム精製で目的物を得る。
QI, Xinxin, et al. A Convenient Palladium‐Catalyzed Carbonylative Suzuki Coupling of Aryl Halides with Formic Acid as the Carbon Monoxide Source. Chemistry–A European Journal, 2015, 21.49: 17650-17656.
また、クロロホルムを一酸化炭素源として利用する方法が2017年に報告されています。同様の方法でエステル合成もできます。
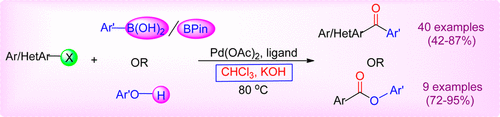
Poonam, S. J. Org. Chem. 2017, 82, 2, 1105-1113 グラフィカルアブストラクトより引用
リガンドとしてはDMAPが良かったみたいです。
オルト位にも
カルボニル薗頭カップリング
薗頭カップリングはアリールハライドと末端アルキンとの触媒的カップリング反応です。これに一酸化炭素を加えたらカルボニルカップリング反応が進行してアルキニルケトンが生成します。
カルボニル源として一酸化炭素を利用した方法が報告されています(2003年)。
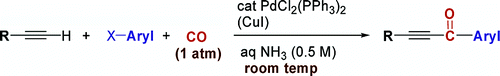
グラフィカルアブストラクトより引用 Mohamed A.et al Org. lett. 5.17 (2003): 3057-3060.
2017年には一酸化炭素源としてギ酸を使った方法が報告されました。
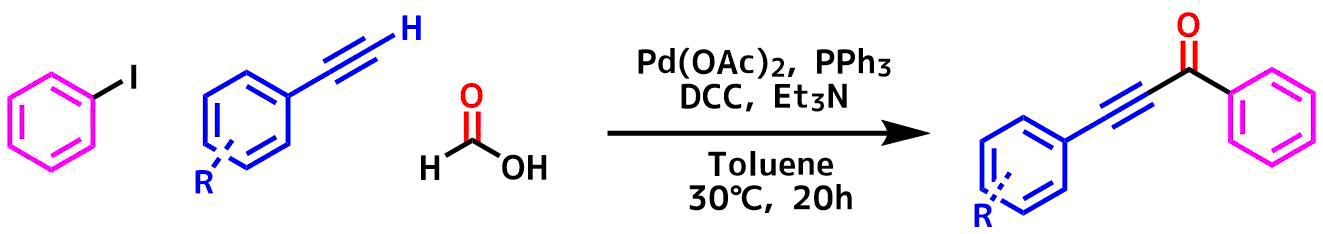
カルボニル園頭カップリング反応
ギ酸を一酸化炭素源としてカルボニル薗頭カップリング反応が進行します。アルキン体はオルト位に置換基が存在すると収率が低下しますが、概ね高収率で進行します。
この論文ではDCCをギ酸の活性化剤として利用してます。鈴木宮浦カップリングの例のように無水酢酸を使っても進行しますが、副生する酢酸を中和するための炭酸カリウムが必要なのでDCCを使っています。
一般的な操作
Pd(OAc)2(3 mol%)およびPPh3(6 mol%)を窒素置換した容器に移し、トルエン(4.0 mL)、ギ酸(2.0 mmol)、アルキン(2.0 mmol)、およびヨウ化アリール(1.0 mmol) を反応管に加えた。 DCC(2.0 mmol)とEt3N(2.0 mmol)を加えた後、チューブを密閉し、混合物を30℃で24時間撹拌した。
Peng, Jin‐Bao, et al. “A Convenient and Efficient Palladium‐Catalyzed Carbonylative Sonogashira Transformation with Formic Acid as the CO Source.” European Journal of Organic Chemistry 2017.11 (2017): 1434-1437.
カルボニル化Stileカップリング
Stileカップリングはアリールハライドと有機スズ化合物との間のカップリング反応です。
カルボニル源としてヘキサカルボニルモリブデンを利用したカルボニル化Stileカップリング反応が2010年にTetrahedron lettersに報告されています。
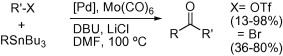
Lindh, J., et al. Tetrahedron Lett. 51.18 (2010): 2470-2472.グラフィカルアブストラクトより引用
多くの基質で良好な収率でケトン体が得られています。
カルボニル化根岸カップリング
根岸カップリングは有機亜鉛試薬とアリールハライドとのカップリング反応です。根岸カップリングでも一酸化炭素を利用してカルボニル化根岸カップリングが進行します。
2008年にニッケル触媒を利用したカルボニル化根岸カップリングがtetrahedron lettersに報告されています。
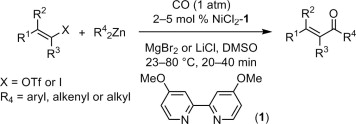
Wang, Qiaoling, et al, Tetrahedron Lett. 49.18 (2008): 2916-2921.グラフィカルアブストラクトより引用
この方法では多少のカルボニル化されていないカップリング体が得られてしまうようです。
Wang, Qiaoling, and Chuo Chen. “Nickel-catalyzed carbonylative Negishi cross-coupling reactions.” Tetrahedron Letters 49.18 (2008): 2916-2921.