検量線は吸光度からタンパク質濃度や活性などを求めるのに使うグラフで、生化学実験などでは基本の実験操作です。検量線は予めわかっている条件から未知の量を求めることができます。
目次
検量線は定量実験の基本
検量線は定量を目的とした2つの値から導き出された関数です。
検量線を使って
- 吸光度から物質(タンパク質や化学物質)の濃度
- 蛍光強度から生物活性
などさまざまな定量ができます。
検量線を引くためには、濃度や量をきちんと測定できる化合物を用意して量を変えて測定します。これによって得られた値から検量線を求めます。標準となる化合物は全く同じもの(場合により似た性質のもの)を使います。
実際の実験では
- クマシーブリリアントブルー(CBB)によるタンパク質の比色分析(CBB)はタンパク質と結合すると吸光極大が465nmから595nmに変化する。
- アルカリフォスファターゼにより生成するp-ニトロフェノールの定量
などがあります。
検量線の使い方
例えば、吸光度から濃度を割り出す例を考えてみます。
ここには、神経伝達物質であるノルアドレナリン水溶液がありますが、濃度が不明なので濃度を調べてみます。
液体の濃度を調べるには吸光度を調べる方法が良いです。ランベルトベールの法則より、吸光度は濃度に比例することが知られているので、モル濃度が二倍、三倍となれば、吸光度も二倍、三倍になります。
例えば、ノルアドレナリンが1mM, 2mM, 4mM…の時の吸光度をそれぞれ測定すれば比例関係のグラフ(検量線)が作れるので、後は未知濃度の吸光度を調べればグラフからノルアドレナリン濃度を求められます。
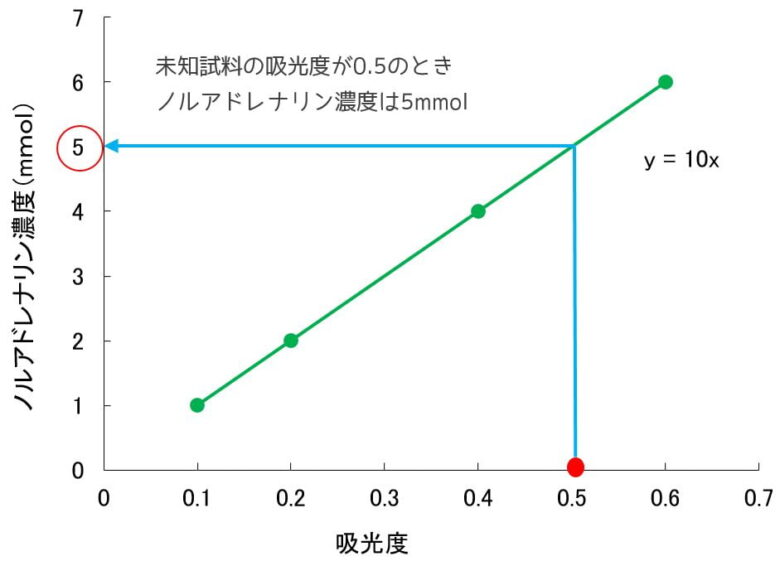
ノルアドレナリンの定量 ノルアドレナリンの1, 2, 4, 6 mMの溶液を調製、吸光度を測定して導き出した検量線をもとに、未知濃度溶液の吸光度0.5から濃度5mmol/Lを求めることができる。
しかし、ノルアドレナリンのUV吸収が弱い、あるいはノルアドレナリンの吸収波長は夾雑物の影響を受けやすいパターンもあります。そういうときは化合物を誘導体化します。例えばニンヒドリンを使った方法があります。
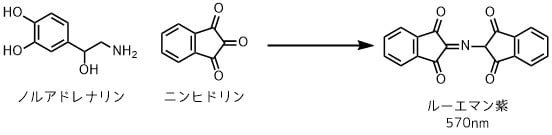
ニンヒドリンによるアミン定量
ニンヒドリンはアミン類と反応してルーエマン紫という化合物を生成します。このルーへマン紫は570nm付近の波長帯で強く光を吸収するので、定量しやすくなります。
やり方は先程と同じでノルアドレナリンの1, 2, 4, 6 mMの溶液、未知試料に対してニンヒドリンを反応させてルーエマン紫を作って、検量線を作り、未知試料の吸光度から濃度を求めます。
検量線は一次式でなければいけないのか?
計測値に対して近似式を与える時に、一次式よりも多項式のほうが高い相関係数が得られることが多いですが、検量線と言えば一次関数が多いのはなぜでしょうか?
実際に2つの値の関係を二次関数などの多項式で理論的に表すことができるのならば1次関数以外の関数を用いても問題ありません。
基本的には検量線の近似式は得られた計測値に対してフィットするものを選択するのではなく、2つの値の間にある関係を理論的に導き出して関数を決定し、近似式として用います。
得られた測定値をもとに、それにフィットする近似式を選択してしまうと、定量性のある検量線ではなくなる場合があります。
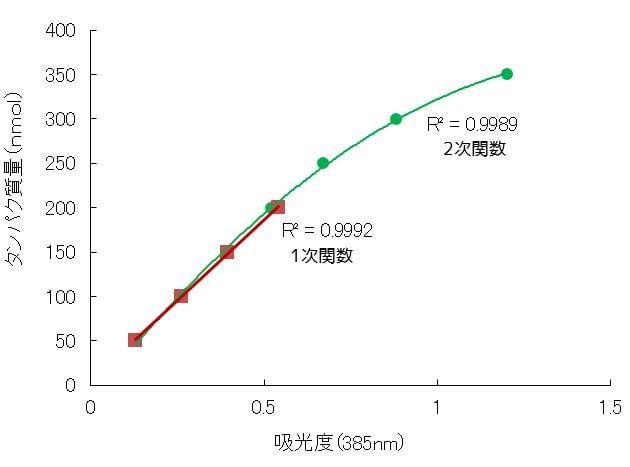
検量線のフィット式
例えば任意のタンパク質量(濃度)における吸光度を測定した結果をグラフにプロットした結果、上図のグラフの緑のような結果が得られました。
これに対して近似式を検討した結果、二次関数を用いた時に最も相関係数が高い結果が得られたのでこれをタンパク質量計算の検量線として用いるのは「ダメです!」
ある条件のもとでは、吸光度と濃度の関係はランベルト・ベールの法則に従います。
吸光度(A)=ε(モル吸光係数)×c(モル濃度)×l(光路長)
モル吸光係数は物質に固有の値であり、光路長はセルを使った測定なので測定毎に変化しない。
したがって、吸光度はモル濃度と比例関係になるはずです。それなのに、検量線に対して二次関数の近似式を用いて検量線を作成してはいけません。
緑のグラフのようにタンパク質高濃度のときに弧を描いてるのはタンパク質が飽和していたり、凝集して乱反射が起きていたりする原因があると考えるべきです。
したがって信頼できる値の範囲(リニアダイナミックレンジ)は50-200nmolまでとなり、それ以降の濃度は使えません。
理論と実際のグラフが異なっているときはなにか起きている(飽和とか手技ミスとかいろいろ)と考えてみましょう。相関係数が低いからといってフィットする近似式を選んで、相関係数が高いからOKと決めてしまうと定量できていないことがあるので注意です。
 こめやん
こめやん