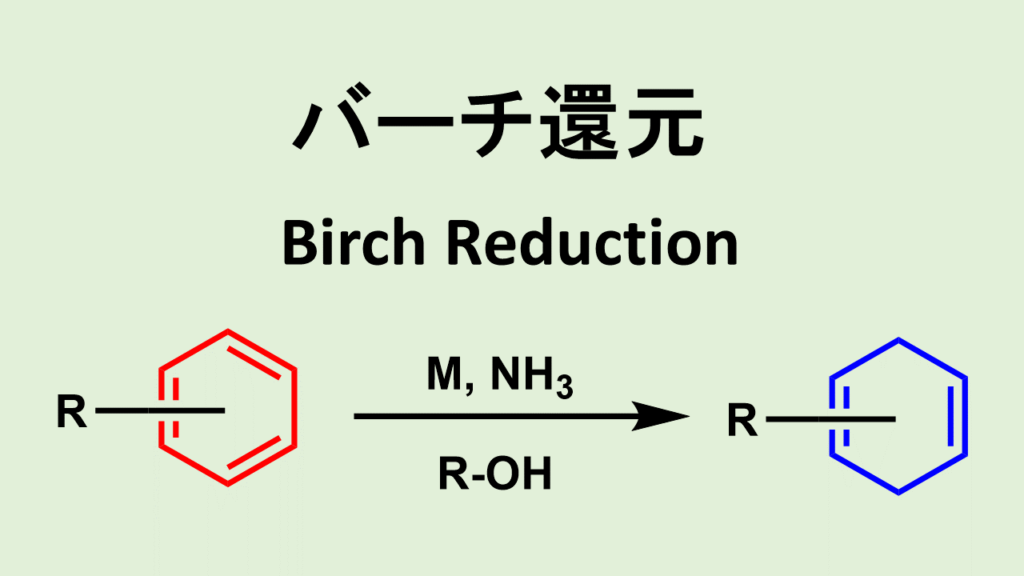
バーチ還元について
アルカリ金属(Li、Na、K)をアルコール存在下、液体アンモニアに溶かし、芳香環の1,4-還元によって対応する非共役シクロヘキサジエンやヘテロ環を得る反応をバーチ還元: (Birch還元)と呼びます。
ピリジンやピロール、フランといったヘテロ環もこの条件で還元されますが、芳香族化合物に置換基がある場合、還元の位置選択性は置換基の性質に依存します。例えば置換基が電子供与性の場合は、還元速度が無置換体よりも遅くなります。置換基の位置は生成物の還元されていない部分になります。逆に置換基が電子求引性基の場合、結果は反対になります。
一般的なアルケンはBirch還元の条件では影響を受けませんが、二重結合が芳香環と共役していなければ分子内にあっても問題ありません。しかし、共役アルケン、α、β-不飽和カルボニル化合物、内部アルキンとスチレン誘導体はバーチ還元で還元されてしまいます。
Birch還元の制限としては、電子豊富なヘテロ環は少なくとも一つの電子求引基をもつ必要があるため、フランやチオフェンの場合は電子求引性基がないと還元されないという点です。
反応の歴史
バーチ還元はBirch, A. Jによって1944年に報告されました。(Birch, A. J. J. Chem. Soc. 1944, 430.)。バーチ還元は他の還元方法とは異なる選択性などを有すること、ベンゼンの部分還元が可能であるという特徴があります。
反応機構
バーチ還元は金属ナトリウムの一電子還元によって進行します。
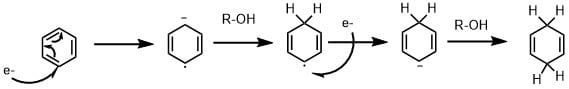
上記のような機構で反応が進行する。第一段階は芳香環への一電子還元によりラジカルアニオンが生成し、プロトン源となるアルコールを加えると脱プロトン化してヒドロベンゼンが生成、さらに一電子還元を受けてアニオン、脱プロトン化によりシクロヘキサジエンが生成します。
バーチ還元の選択性
バーチ還元は置換基が存在した場合、反応の選択性が変化します。具体的には、
- 電子吸引基→1,4-ジヒドロ体 (Ph, COOH,CONH2,)
- 電子供与基→2,5-ジヒドロ体 (アミノ基、アルコキシ基、アルキル基)
電子供与および電子吸引基が共存する場合その数などによるが一般的にカルボキシル基(電子吸引基)が優先されます。

ナフタレンでは1位(左)に電子供与性基がある場合は5,8位が還元、2位の場合は1,4還元が優先されます。
官能基許容性
バーチ還元は比較的強い還元条件であるため、耐えられる官能基に限りがあります。
侵される官能基: Ar-OR、ケトン、芳香族アルデヒド(アルカンに還元)、エステル、脂肪族アミド(アルデヒドに還元)、ニトロ基、ニトリル、スルフィド、チオケタール、アルキン、オレフィン、ハロゲン、
耐える官能基: 脂肪族アルデヒド(アセタール形成による)、カルボン酸、脂肪族アルコール、アミン
実験手順
バーチ還元は液体アンモニアを溶媒として利用するため、少々特殊な装置が必要です。気体のアンモニアを冷却して液体とします。用意する器具としては
- デュワー冷却器で、ドライアイスなどを入れて低温冷却する装置です。
- ドライアイス-アセトンあるいはアルコール浴(反応容器冷却用)
- Birch還元専用撹拌子(できればガラス製、テフロンは変色する)
- アンモニアボンベ
ドラフト内でデュワー冷却器にアンモニアガスをゆっくりと通じて液化させる。その後ナトリウムあるいはリチウムの小片を加えて溶解させる(濃青色の液体に変化する)ここに基質をエーテル等に溶解させて加える。溶解しにくい場合は基質がはいったフラスコにアンモニアを加えて最後に金属を加える方法でも良い。反応終了後は水、塩化アンモニウム水溶液等をゆっくりと滴下してクエンチ後、アンモニアを蒸発させて精製処理する。