地球環境汚染は1970年以降から世間を賑わすようになっていました。
今でこそ落ち着いていましたが、1990年代以降には地球温暖化問題が取り沙汰され、オゾンホール、酸性雨、砂漠化、農薬汚染、放射能汚染などあらゆる環境問題が話題になっていました。
このような環境汚染のうち最も影響を環境が影響をうけやすいのは何か?というと大気ではないか?ということになります。
何故かと言うと、物質の存在量でみると大気が最も少ないからです。(水などは最も多い)
汚染というのが本来ない成分の混入であると考えると、量が少ないと汚染物割合もより少な量になるということです。
大気は流動性がおおきいということも要因です。1986年のチェルノブイリ原発事故では、大気中を放射性物質が舞って、世界各地で放射性物質が検出されました。日本でも中国からの黄砂やPM2.5などが問題になっていますよね。
大気の成り立ち
大気は極域と赤道域との温度差や自転によって対流が生まれるため、よくかき混ざり混合が早いので、地球上どこでもおなじ化学組成になっています。
対流圏(troposphere)
大気圏のなかで最も地表に近い圏は、対流が多いために「対流圏」と呼ばれています。対流圏は、高度12kmくらいまでです。対流圏では高度が高くなるほど温度が下がります。
成層圏(stratosphere)
高度12km-50kmは大気の流れがなくなり、空気が積み重なるようになるため「成層圏」と呼ばれます。温度の低い空気は密度が高いため、温度の低い順に積み上がっていきます。この成層圏では、太陽光線が強く、高度が高くなるほど強くなるため、紫外線を吸収する酸素やオゾンによって生じる熱が大気を暖め、高度が高くなるほど温度が上昇します。オゾン層もこの成層圏にあります。
成層圏よりも上の高度120kmくらいまでにはほとんど大気中に分子は存在せず、存在していても紫外線により分解して原子の状態で存在しています。高層に行くほど、水素やヘリウムなどの軽い元素の存在比が大きくなります。成層圏の上は中間圏(Mesosphere),熱圏(Stratosphere)となります。
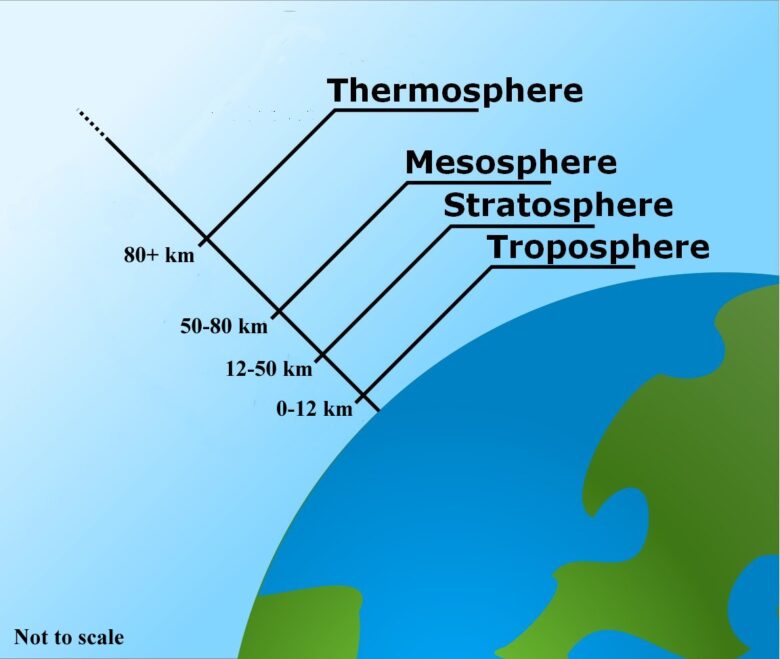
オゾン層破壊が問題になりやすいのはなぜ?
オゾン層は成層圏にあります。ところで、大気中にある気体の「9割」が対流圏に存在しています。成層圏には1割もありません。そこにオゾン層を破壊する化学物質が入り込んだらどうなるでしょうか?
成層圏には大気が少ない分、ごく少量の汚染物質でも影響を受けやすくなります。さらに、対流が無いために一度汚染されると長期間影響を受け続けるということになります。
大気の組成と変化要因
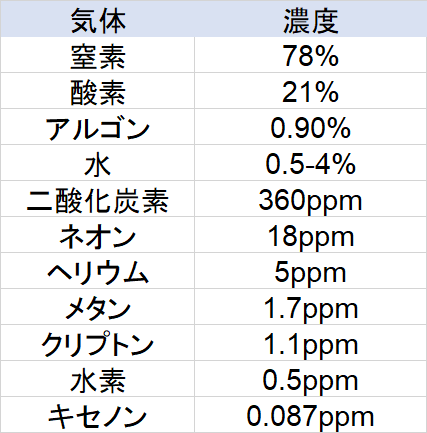
大気組成は上の表の様になっています。アルゴンが多いのは驚きでしょうか?それと二酸化炭素は思ったり少ないと感じませんか?
重要なのは窒素や酸素といった量の大きな気体ではなく微量成分の変動などが重要となります。こうした微量成分の変動は人間活動によって増える場合が多いです。
乾燥体や熱帯など場所によって変動するため0.5-4%という表記になっています。二酸化炭素などは人間が化石燃料を燃料したことによって増えたと考えられています。
大気成分の変化要因はほかのにも
・隕石
・火山活動
・微生物活動
大気成分の化学反応
大気中の成分で最も反応性が高いのはヒドロキシラジカルです。
ヒドロキシラジカルはオゾンより生成します。
チャップマン機構
O3+hv→O2+O(1D) :励起一重項酸素原子の生成
O(1D)+H2O→2(・OH)(ヒドロキシラジカル)
酸素原子は酸素原子と反応すればオゾンが再生される。
反応性の高いヒドロキシラジカルは、二酸化窒素(NO2)と反応したとき、硝酸ができるため、酸性雨の原因となる。
オゾン層を破壊する塩素化合物
オゾンは成層圏で太陽から注がれる紫外線を吸収しているため。有害な紫外線から生物を守っています。
紫外線にはUV-A(320~400nm),UV-B(280~320nm),UV-C(280nm未満)という分類があり、UVは短波長なものほど高エネルギーで有害です。
一般に日焼けと言われているものはUV-Aの紫外線で、これはほとんど吸収されずに地表に届きます。
UV-Cは酸素に吸収され、地表には届きません。一方UV-BはDNAを損傷させて皮膚がんを誘発するなど有害ですが酸素には吸収されません。
先程出てきたオゾンが分解され酸素原子を生成する反応は光反応で、UV吸収によって起こります。実はこの波長が、230nm <λ< 340nm(中心波長290nm)の光を吸収する。つまり、オゾンの光分解反応にはUV-Bの波長の光が使われるため、オゾン層によってUV-Bは地表に届かなくなるということです。
常に太陽から降り注ぐUVによって、オゾンは分解されるので、オゾンはいずれなくなってしまうか?というとそうではありません。光分解によって生じた酸素原子は再び酸素分子と反応してオゾンが再生されます。
オゾンを破壊する分子はどのような反応を起こすか?
オゾン層を破壊する化学物質といえばフロン類です。たとえば、CFCl3(フロン-11)は、成層圏まで達して、紫外線を吸収すると、
CFCL3+hv → CFCl2 + Cl と塩素原子を生成します。この塩素が、
O3 + Cl → O2 + ClO
ClO + O → O2 + Cl
このようにオゾンは酸素分子と一酸化塩素ラジカル(ClO)を作り、さらにどこかで紫外線で分解してできたOとClOが反応して、酸素分子を作るため、
オゾンも分解されるし、酸素原子とも反応するため、オゾン再生も阻害します。さらに、その過程で塩素原子が生成するため、連鎖がおきてオゾンは破壊し続けられます。
オゾン層破壊を防ぐには
1987年にはモントリオール議定書により、先進国が50%フロンを削減、以降1992年にかけてフロンを全廃に向け強い規制がしかれました。現在2018年では待機中のフロンは減少傾向です。フロンは非常に安定で100年以上も存在すると言われています。オゾン層の破壊を防ぐには、フロンをできるだけ大気中に放たないようにするしか方法がありません。