アニリンはインディゴなどの色素やサルファ剤などの医薬品、ゴムの硫化促進剤など様々な用途に使われる重要な物質です。
アニリンは反応性が高いため、様々な芳香族化合物の合成中間体となりますから、テストや化学実験などにもってこいの題材になります。
今回は様々なアニリンの合成のうち、ニトロベンゼンからの還元について紹介します。
ニトロベンゼンの還元は金属+酸条件
ニトロ基の還元は鉄や亜鉛、スズなどの金属と塩酸などの酸を使る金属還元を使うのが最もシンプルな還元方法です。
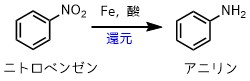
ニトロベンゼンの還元でアニリンを作る
中でも鉄を使った還元は弱酸性の塩化アンモニウムでも反応が進行することから、より安全で温和な反応としてよく使われています(べシャン還元)
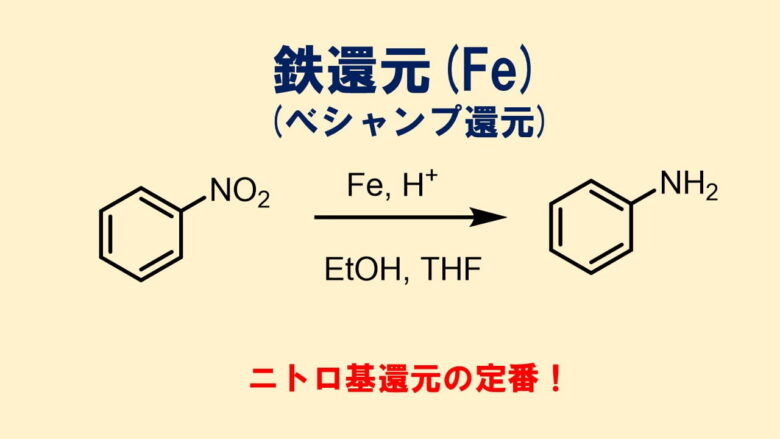
還元反応の操作は簡単!
ニトロベンゼンをアニリンに還元する方法はとても簡単です。
- ニトロベンゼンにスズあるいは鉄粉を適量加えて、濃塩酸(6Mくらいの希塩酸でもOK)を適量加えて攪拌します。
- 撹拌子を使って攪拌しない時は揺り動かしながら、60℃くらいに温めます。
- 生成したアニリンは塩酸塩になっているので、水酸化ナトリウム水溶液を加えてアミノ基に戻します。
- 分液ロートに反応液を加えて有機溶媒(エーテルや酢酸エチル)で抽出する。
- 有機層を濃縮してアニリンを得る
ニトロベンゼンの還元に使う試薬は適当な量を加えても還元できます。非常に簡単な実験です。
鉄還元の反応機構
ニトロベンゼンの酸素が外れて水素に置換するわかりやすい還元反応ですが、その反応機構は意外とちゃんと把握している人は少ないかもしれません。
どの金属でも同じで酸による酸素のプロトン化と金属による一電子還元(SET)によって還元反応が進行します。
ニトロベンゼンからアニリンができるまではニトロソベンゼン、ヒドロキシルアミンという中間体を経由します。シンプルにみると、「二重結合の還元」と「酸素の水への変換」でアニリンに還元しています。
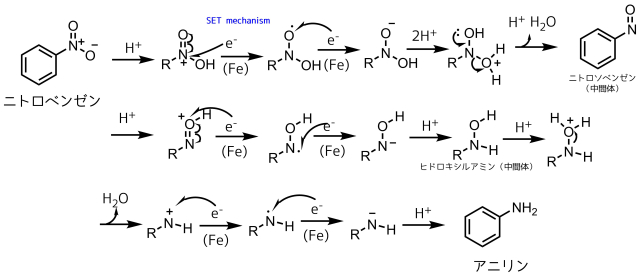
ニトロベンゼンの還元の反応機構
アニリンの検出方法
アニリンの検出は酸化剤によって生成する重合体の「アニリンブラック」を使って視認します。
よく使われる酸化剤はさらし粉(次亜塩素酸カルシウム)、ニクロム酸カリウムなどがあります

ニトロベンゼンとスズと塩酸からアニリン塩酸塩をつくりそこから弱塩基遊離反応によってアニリンが生成される反応の反応機構はわかりますか??
これをレポートで書かないといけなくて困っています。
スズを用いてニトロベンゼンをアニリンに還元する反応機構はこちらに載っている鉄による還元の反応機構と同じと考えてよいと思います。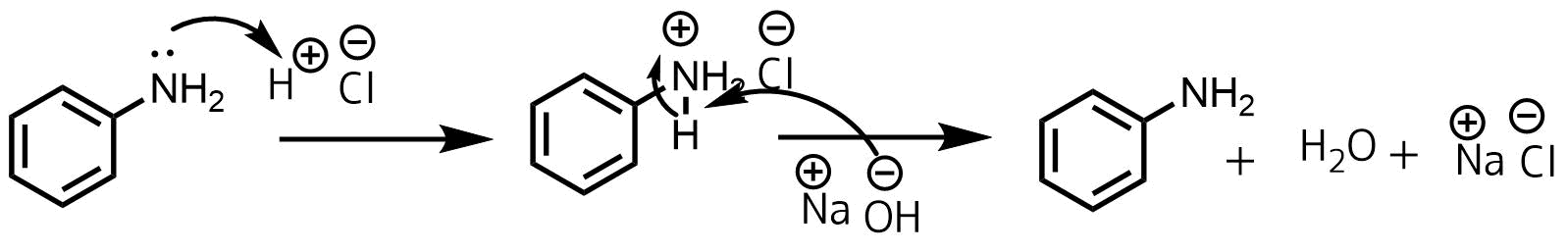
アニリン塩酸塩は強酸の塩酸と弱塩基のアニリンからなる塩なので酸性を示します(プロトンが放出しやすい)。そのため例えば強塩基のNaOHを加えると強塩基の水酸化物イオンがプロトンを奪ってアニリン、水、塩化ナトリウムが生成します。
[caption id="attachment_13128" align="alignnone" width="1598"]
わかりやすい説明ありがとうございます
助かります
反応機構でニトロベンゼンの次の状態においてNとOの右にそれぞれ矢印のようなものがありますがそれはどのようなのでしょうか??
反応機構でニトロベンゼンの次の状態においてNとOの右にそれぞれ矢印のようなものがありますがそれはどのようなのでしょうか??
窒素と酸素の上下にある矢印はN-O結合がホモリシスしてラジカルが発生しているのを表しています。
一応詳しく説明します。お分かりでしたら読み飛ばしてください。

結合の開裂にはヘテロリシスとホモリシスがあります。
ヘテロは”不均一に”という意味があり、1本の結合を作っている2電子が片方の原子に「偏って(不均一に)」分裂し、結合が開裂します。これをヘテロリシスといい一般的に有機化学でよくみられる結合開裂です。
ホモには”均一に”という意味があり、1本の結合を作っている2電子が両方の原子に「均一に」分裂して結合が開裂します。これをホモリシスといい、生じた核種をラジカルと呼びます。ラジカルが関わる反応はあまりシンプルでないので目にする機会はないかもしれません。代表的なラジカル反応はメタンからクロロアルカン(CH4+Cl2→CHnCln + HCl)が生じる反応です。
図中の反応機構はSET機構(single electron transfer:一電子移動)と書いてありますが、文字通り鉄やスズなどの金属から電子が一つ飛び出してニトロ基の窒素に移動しています。このような還元方式を一電子還元と呼ぶこともあります。ラジカルは不安定なため通常は自発的にホモリシスして発生することはありませんが、電子が外部から与えられたことによってラジカルが発生します。ラジカルはさらにもう一電子与えられたらマイナスイオンになります。酸性中には電子不足なカチオンのH+がいるのですぐに結合形成してOHになります。後は同じような感じでどんどん還元が進行します。
ホモリシス-wikipedia
メタンからクロロホルム生成-wikipedia