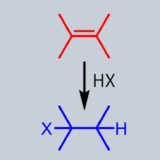
電子豊富なアルケンは求核付加反応を起こしやすく、ハロゲン化水素やハロゲン単体と反応してハロゲン化アルキルを生成します。
本記事ではアルケンのハロゲン化(塩素化、臭素化を中心)について紹介します。
アルケンのハロゲン化
ハロゲンは容易にアルケンと付加反応を起こしてジブロモ体を生成します。塩素のほうが反応しやすいです。塩素ガスは反応性が高く取り扱いも難しいため、合成上重要で取り扱いやすいのは臭素化のほうです。臭素も猛毒ですが液体なので塩素よりも扱いやすいです。塩素化は塩素ガスよりも塩化スルフリルを使うことが多いです。
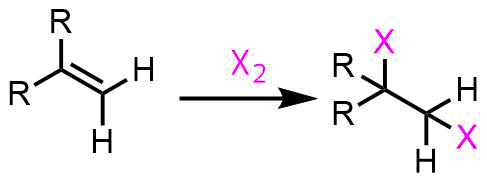
アルケンのハロゲン化ー付加反応
ハロゲン化の反応機構と選択性
ハロゲン化はアルケンが臭素へ攻撃することによって開始されます。すぐに臭素がもう一方の炭素に攻撃して三員環のブロモニウムイオンを生成します。これに臭素アニオンが背面から攻撃して1,2-ジブロモ体が生成します。
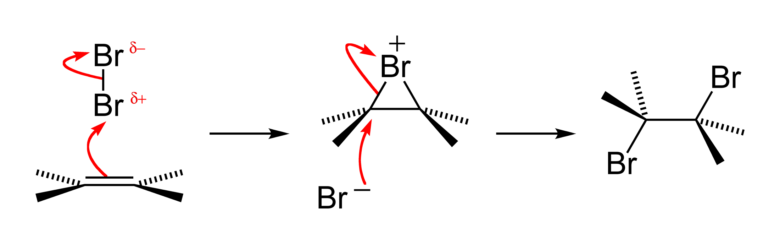
from wikipedia public domain
背面から攻撃するためanti-体が得られます。
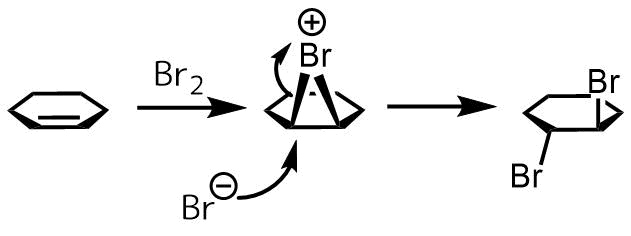
アルケンのハロゲン化ートランス付加
臭素のアルケンへの付加反応は早く、他の反応性の部位よりも優先的ですが、臭素の過剰な添加は副反応を起こすので避けたほうがよいです。
ケトン・アルデヒドやアミノ基、アルコール、カルボン酸、アセタール、エステルが存在していもOKです。α,β不飽和カルボニルはアルケンが臭素化されます。ベンジル位、アリル位やカルボニルα位の臭素化などよりも付加反応が優先します。
臭素化は塩素化と比べて立体障害を受けやすく一部の傘高いアルケンは反応が進行しにくいことがあります。ヨウ素は付加反応を起こしにくいです。
反応条件
溶媒
ハロゲン系溶媒(クロロホルム、ジクロロメタン、四塩化炭素)エーテル、酢酸などが使われる。
温度・光
副反応は熱によって起こりやすくなるため、反応は冷却(0℃以下)して行います。日光や蛍光灯などの光を当てて反応を促進することもあります。
添加物
水など溶媒にした場合反応中に副生するハロゲン化水素による異性化を防ぐため炭酸カルシウムなどの弱塩基共存下で反応することがあります。
臭素化剤
臭素化剤は臭素が基本ですが、反応性の高さや毒性、取り扱いが難しいです。臭素錯体は反応性が穏やかで取り扱いやすいです。ジオキサン臭素錯体、ピリジン臭化水素・臭素錯体などがあります。
臭素を使ったハロゲン化
臭素を使ったハロゲン化は主にハロゲン系溶媒及び、水、酢酸を用いて臭素化することが多いです。スチレンのような共役アルケンあるいは脂肪族末端アルケンなども同様の条件で臭素化されます。ニトロやニトリルなどの電子求引基が共役したアルケンでも臭素化されます。

Loy, Nicole S. Y. et al Organic Letters, 17(3), 395-397; 2015
0℃に冷却したDCM(10 mL)アルケン(5 mmol)の溶液に、臭素(1.2 eq)を滴下し氷浴で1時間撹拌した。 反応を飽和チオ硫酸ナトリウム水溶液でクエンチし、オレンジ色が消えるまで激しく撹拌した。次いで、反応物をセライト濾過し、DCMで洗浄した。濃縮、カラム精製により目的物を93%で得た。
ブロモスクシンイミド NBSを使った臭素化
ジブロモ化では臭素単体を用いたほうが収率が高いですが、安全性の高い臭素の代替試薬として有用なNBSを用いた臭素化も可能です。
2当量のNBSを加えてクロロホルム中還流することによってジブロモ体が得られています。
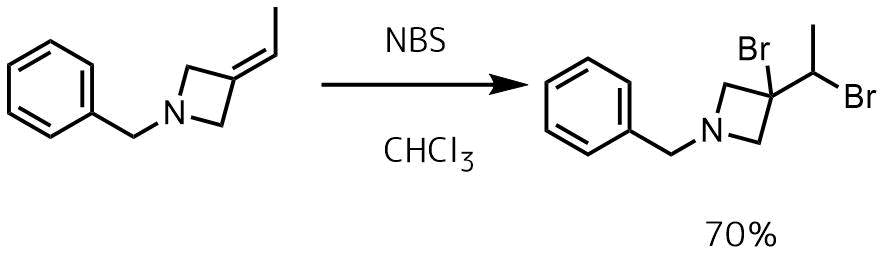
Stankovic, Sonja et al Synlett, 25(1), 75-80; 2014
NBSはフッ素ー臭素アルカンを合成するのに良く利用されます。1当量のNBSにフッ化水素アミン塩を加えると片方の炭素にフッ素が結合したブロモアルカンが生成します。
Wong, O. Andrea and Shi, Yian Journal of Organic Chemistry, 74(21), 8377-8380; 2009
塩化スルフリルを用いた塩素化
塩素ガスは取り扱いに難有りのため代替品としては塩化スルフリルが使われます。副反応の心配がない化合物では塩化スルフリルのみで反応させることもあります。基本的には溶媒中で撹拌させるだけです。

Zeng, Xianghua et al RSC Advances, 6(88), 85182-85185; 2016
アルケン(0.2 mmol)、塩化スルフリル(0.21 mmol)、トリフェニルホスフィンオキシド( 5 mol% )をクロロホルム(1 mL)中で室温で撹拌し、分液、カラム精製により目的物を86%で得た。
この方法はジアステレオ選択性が高く塩素化できます。