高校化学で登場する物質量、モル、アボガドロ定数はとっても重要な基礎ですが、慣れないとイメージしにくいので多くの脱落者を出す第一関門です。
ここでは物質量やモルについてできるだけわかりやすく解説していきます。
物質量は実はすごく簡単!まずは物質について知ろう!
まず化学の基本をおさらいしましょう。
身の回りの物質は水素や酸素、炭素、鉄といった元素がたくさん集まってできています。
例えば紙は拡大すると糸状のせんいがたくさん集まってできています。この糸一本はセルロースという長くつながった分子からできています。このセルロースは実は一個のブロックとなる分子が繰り返しつながっています。この一個のブロックは甘いブドウ糖です。ブドウ糖がどんな元素からできているか見やすくすると一番右下の形になります。ブドウ糖は炭素6個、水素12個、酸素6個からできていることが分かります。

紙はどんな元素からできているの? 紙はグルコースという分子がたくさんつながってできている。
紙だけではありません。身の回りの全ての物質はこのように炭素や水素、酸素などの元素の組み合わせからできています。
水も水分子がたくさん集まってできています。鉄も鉄の元素がたくさん集まっています。
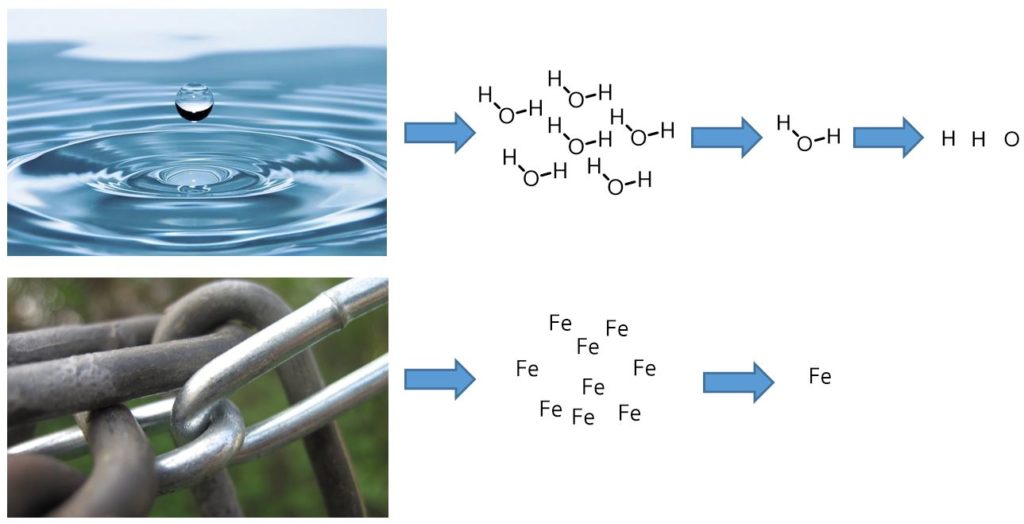
鉄や水も元素からできている
一体これらの物質はどうやって作られたのでしょうか?
それは化学反応が起こって元素同士がつながったからです。
水を例に考えてみましょう。
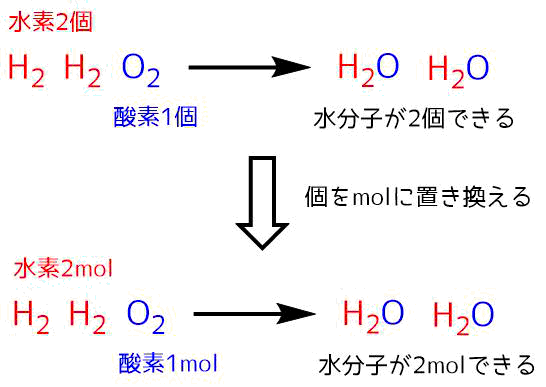
水は水素原子2個と酸素原子1個からできています。この水は水素ガス(H2)と酸素ガス(O2)から合成できます。酸素原子が一個余ってしまうので水素ガスは2分子分用意します。酸素ガスは1分子分でOKです。これを化合させると水分子が2分子できます。
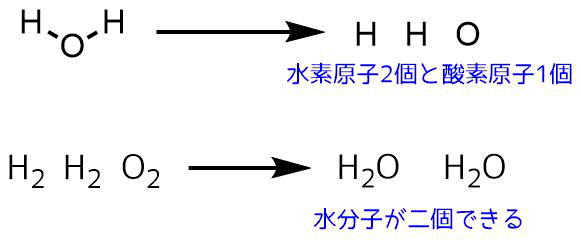
水の作り方
ここまでが物質と元素の基礎です。次にようやく物質量の話に入ります。
化学反応を考えるときに困るから物質量がある!
実際に水素分子と酸素分子を化合させる実験を考えます。
水素が2分子に対して酸素を1分子の比率(H2:O2=2:1)で用意する必要があります。水素が2万個なら酸素は1万個です。
しかし、目に見えない分子の個数をどうやって数えることができるでしょうか?気体なのでつかむことすらできません。
しかし、私たちは同じく目に見えないはずの水の量をいつも測定しています。実は目に見えなくてもつかめなくても物質を測定する方法はあります。
- 質量(gとか)
- 体積(mLとか)
です。
気体でも質量は測定できます。
質量1gの風船に水素を入れて質量をはかって3.0gなら3.0-1.0g=2.0gの水素が入っていることが分かるからです。
水素を2g用意したら、酸素を何グラム用意する必要がありますか?
水素:酸素=2:1なので、酸素は1g→不正解!
考え方は正しいのですが、間違っているのは重要な点を見逃しているからです。
水素分子一個の質量と酸素分子一個の質量が違うからです。水素は体重が軽く、酸素は体重が重いです。
有名な周期表では番号が小さいほど軽いです。水素は1番、酸素は8番目です。
from wikipedia Sandbh [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)]
では水素と酸素一分子の質量はどれくらいなのでしょうか?
分子はものすごく小さいです。そのため一個分の質量を知ったところで実際に実験するには不便ですね。
紅茶に砂糖を入れる時に喫茶店で「砂糖の結晶は何粒入れますか?」と聞かれても困ります。角砂糖やスティックシュガーなどひとまとまりにしてくれたほうが扱いやすいはずです。1ダース(12個)も同じですね。小さいものはだいたいひとまとめのセットで売られたりしているはずです。
同じように分子も何粒かセットにしたほうが扱いやすいのです。
そこで登場するのが「物質量:単位はモル(mol)」です。物質量とモルの関係は
- 体重→kg
- 物質量→mol
と同じです。
物質量とは文字通り「物質の量」です。どのくらいの数含まれているか?を表します。
では1molには分子何個セットなのか?これは
「6.0×1023個」です。
6000垓個(垓は京の次の単位)もの分子が含まれていると考えるとものすごい量ですね。
1molあたり6.0×1023個→6.0×1023/molをアボガドロ定数という
1molは実験するにも扱いやすい量です。例えば水1molは18gです。
18gくらいだったら質量をはかりやすいし、考えやすいですよね。(この中には6.0×1023個の水分子がいる)
水素分子は1molあたり2g、酸素分子は1molあたり32gです。このように同じ個数でも元素の質量が異なるので質量は違います。
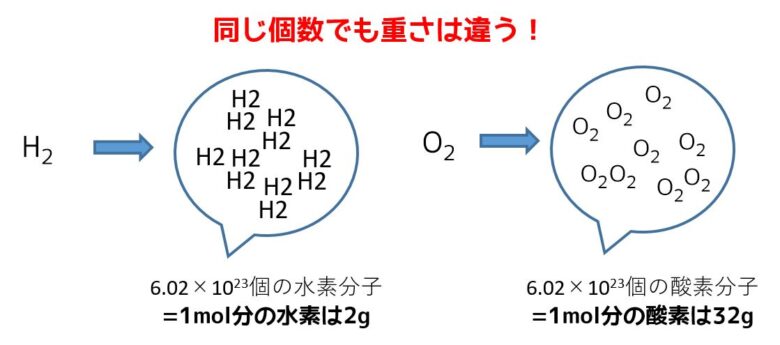
このように分子1mol当たりの質量のこと→g/molをモル質量といいます。
水素分子のモル質量は2g/molです。酸素分子のモル質量は32g/molです。
つまり、水素1mol分と同じ個数の酸素分子は32gだということです。
酸素原子一個分の質量は水素原子の一個の16倍も重いのです。
実際にモル質量を計算してみる
もう一度先ほどの問題を考えてみます。
水素を2g用意したら、酸素を何グラム用意する必要がありますか?
水素2gは何モル分なのかを考えます。水素のモル質量は2.0g/molです。
2g ÷ 2.0g/mol = 1.0 mol
なので、水素2gは1.0mol分あります。
水をキリよく作るには、水素分子2個に対して酸素分子が1個必要です。→水素分子2molに対して酸素分子が1mol必要です。
必要な酸素の物質量をx molとすると水素は1molあるので
- 1mol (今ある水素の物質量):x mol(必要な酸素の物質量) = 2mol(水素の物質量) :1mol(酸素の物質量)
- 2x = 1
- →x = 1÷2 = 0.5 mol
水素2gは1molなので必要な酸素の物質量は0.5mol
ちゃんと2倍して比を見たら2:1になっています。ただし、答えは何グラムの酸素が必要か?ということを聞かれているので酸素の質量を出します。
酸素のモル質量は 32 g/molなので、
32 g/ mol × 0.5 mol=16g
必要な酸素は16g
水素2gと酸素16gを用意すれば酸素や水素が余らずに水が生成します。
何モルの水ができますか?
H2が1molと酸素が0.5molで何モルの水ができるのでしょうか?
これは実際の個数を考えるとわかりやすいです。水素2個と酸素1個から水が2個できます。これは個をmolに置き換えても数は同じなのでOKです。すると水素2molと酸素1molから水分子が2molできることが分かります。
水分子の生成を考える
水素1molなので水は1molできます。
気体と物質量の関係
物質には気体、液体、固体の3つの状態を取ることが知られています。
水で例えれば気体は水蒸気、液体は水、固体は氷です。みためは異なりますが、構成する分子はどれもH2Oです。H2Oの並び方?が異なるだけです。
ところで気体に関しては面白いことが分かっています。同じ状態(標準状態:温度0℃、1気圧)ではどんな気体も1molは22.4 Lということが知られています。
酸素も22.4Lで1mol、水素も22.4Lで1molです。なので気体は同じ体積であれば同じ個数の分子がその中に含まれているということです。1mol当たり22.4Lは6.02×1023個
まとめ
- 物質は物凄くたくさんの数の元素からできている
- 物質量(mol)は1ダースと同じで原子や分子のセット数(1mol=6.02×1023個)
- 1mol当たりの個数をアボガドロ定数と呼ぶ
- モル質量は1mol当たりの質量
問題に挑戦できます!よかったら試してみてください。ニックネームを入力して開始してください。



