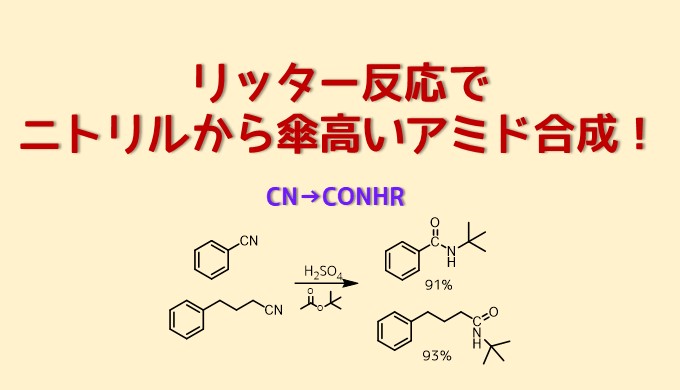
リッター反応はJhon J. Ritterによって1948年に発見された人名反応です。
リッター反応はニトリルが求電子アルキルと反応してN-アルキルアミドを生成する反応です。
初期の反応は求電子剤としてイソブテンを使った反応です。
本記事ではリッター反応の特徴と利点などを紹介します。
リッター反応でN-アルキルアミドを合成
リッター反応の基本はニトリルとイソブテンとの反応です。
イソブテンは酸性溶液中でプロトンによる求電子付加反応を受けて安定な第三級カルボカチオンが生成します。これにニトリルの孤立電子対が求核攻撃してニトリウム種が生成しこれが加水分解してアミドになります。
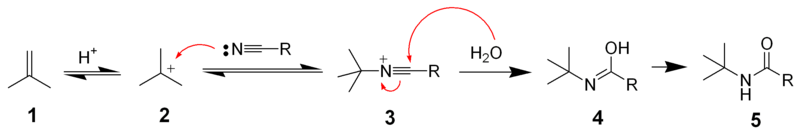
リッター反応の反応機構 from wikipedia public domain
tert-ブチルアミドなどの傘高いアルキル鎖をアミドに導入するのは結構大変なので、リッター反応はアミドへ第三級アルキル鎖を導入する方法として優れています。
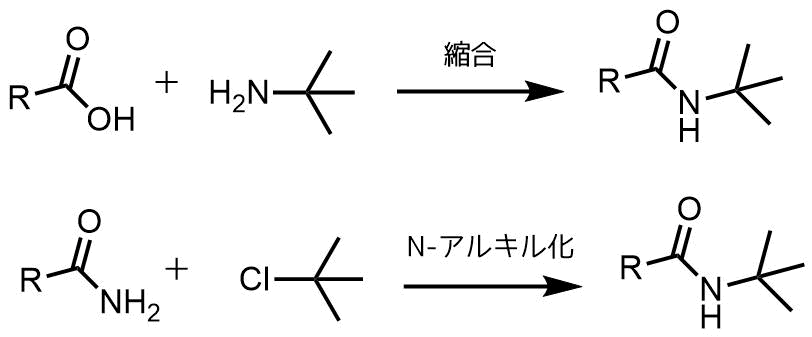
傘高いアミンの求核アシル置換は進行しにくい。アミドの求核性は低くアルキル化は進行しにくい。
リッター反応はいくつかの医薬品におけるtert-ブチルアミドの合成にりようされています。
インジナビルの構造 from wikipedia public domain
リッター反応の特徴
リッター反応の利点
リッター反応の利点としては
- 傘高いアルキル鎖をもつN-アルキルアミド合成に適する
- カルボン酸を経由しないで合成可能(別の合成経路)
などがあります。
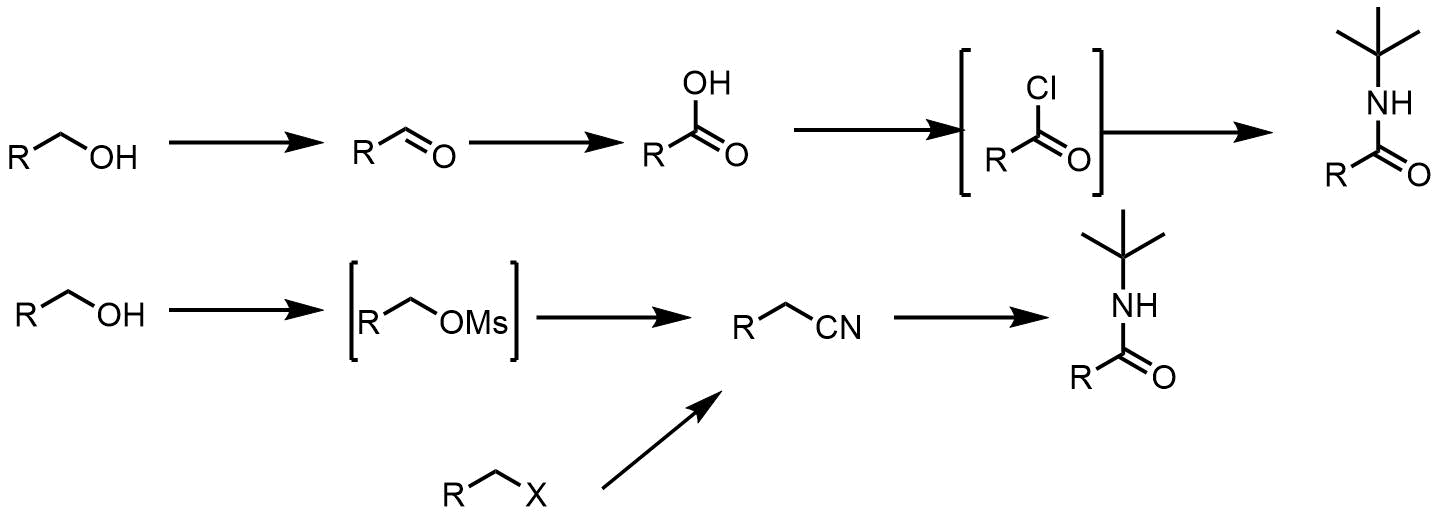
N-tertブチルアミドの合成経路
アルコールを原料としたときにカルボン酸から合成する経路では酸化反応をする必要があり、取り扱いが難しいアルデヒドやカルボン酸を経由しますが、リッター反応では脱離基に変換してそのままニトリルに置換後アミドに変換できます。
リッター反応の欠点
- 強酸に強い基質しか使えない
- カルボカチオンを生成しやすい傘高いアルキル鎖以外は導入が難しい
反応条件
反応条件としては濃硫酸を化学両論量用いる方法が古典的なリッター反応です。
カルボカチオンの供給源としてはtert-ブチルアルコール等の第三級アルコールを使います。
リッター反応はカルボカチオン生成種、溶媒、酸の組み合わせによって大きく収率が変化することが知られています。
特にtert-ブチルアミド合成では2002年K.Laxma Reddyによって硫酸と酢酸tert-ブチルエステルの組み合わせが最も効率的であることが示されていました。
Reddy, K. Laxma. “An efficient method for the conversion of aromatic and aliphatic nitriles to the corresponding N-tert-butyl amides: a modified Ritter reaction.” Tetrahedron letters 44.7 (2003): 1453-1455.

リッター反応例1 Reddy, K. Laxma. Tetrahedron letters 44.7 (2003): 1453-1455.
一般的操作法
還流管、温度計を付けた3口フラスコに酢酸tert-ブチル(75.0 mL)、4-メトキシベンゾニトリル(13.3 g、100 mmol)の溶液に濃硫酸(5.0 mL)を室温で約5分間かけてゆっくり加えて、溶液を42℃で2.0時間撹拌し、反応混合物を冷たい20%KHCO3水溶液(250 mL)に注ぎ、酸を中和し、生成物を沈殿させた。生成物を濾過し、冷水で洗浄し、真空下で乾燥させて、アミド(19.5g、収率95%)を得た。
MeO-, CF3O-、ニコチン酸など様々な基質で9割以上の収率で得られています。
Sanz, Roberto, et al. “The Ritter reaction under truly catalytic Brønsted acid conditions.” European Journal of Organic Chemistry 2007.28 (2007): 4642-4645.
しかしこの方法はtertブチルアミド合成にはあまり向いていないようです(中程度の収率)。
溶媒はクメンを利用していますが、トルエンやジオキサンでも可能です。
一般的な反応手順
ニトリル(1mmol)、アルコール(1mmol)、クメン(1.0 mL)およびFeCl3・6H2O(10モル%)の混合物を密閉チューブに入れ、150℃で撹拌し、濃縮、酢酸エチルと水を加えてセライトろ過後、硫酸ナトリウムで脱水、カラム精製により目的物を得る。
Anxionnat, Bruno, et al. “FeCl3-catalyzed Ritter reaction. Synthesis of amides.” Tetrahedron Letters 50.26 (2009): 3470-3473.
参考
参考 Ritter reaction - Wikipedia
1)Guérinot, Amandine, Sébastien Reymond, and Janine Cossy. “Ritter reaction: recent catalytic developments.” European Journal of Organic Chemistry 2012.1 (2012): 19-28.