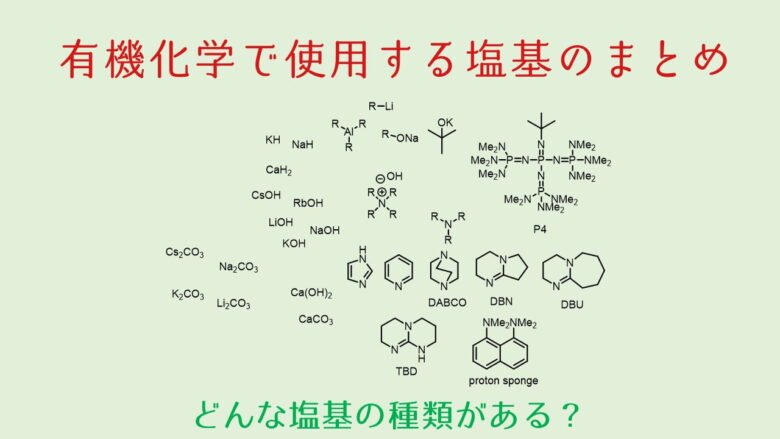
水素化カルシウム CaH2は通称カルハイと呼ばれている強塩基です。有機合成反応に利用することもありますが、有機溶媒の蒸留に利用することが多いかもしれません。アルカリ金属の水素化物と比べて反応性は高くありませんが、それでも水との接触によって、激しく反応するので注意が必要です。特に溶媒の脱水・蒸留に利用することから大量に使うことが多いので注意が必要です。
水素化カルシウム CaH2とは?
水素化カルシウムは CaH2の化学式で示されるアルカリ土類金属の水素化物です。研究室では「カルハイ」と呼ばれることが多いかもしれません。
 こめやん
こめやん
水素化カルシウムは他の水素化物と同様に水などと激しく反応して水素ガスを発生させますが、他の水素化物よりも反応性が低いため、塩基として利用する例はNaHなどと比べると少ないです。一方で他の水素化物と比較して緩やかな反応性を利用して有機溶媒の脱水に利用されることが多いです。水素化カルシウムも有機溶媒には不溶性です。
水素化カルシウムのプロパティ
- MW: 42.1
- 化学式: CaH2
- 融点 : 816℃
- 密度 : 1.902
- 溶解度 : 水と反応、多くの有機溶媒に不溶、
安価で、反応性も穏やかなため、水素ガス発生源としても利用されることが多いです。
水素化カルシウムは溶媒蒸留の乾燥剤
水素化カルシウムの使用用途の一つに溶媒の乾燥があります。水素化リチウムアルミニウム (LAH)などを利用することもありますが、反応性が高く危険なためあまり積極的には使いたくありません(他の水素化物:NaHやKHはオイルが入っているので蒸留には適さない)。
そこで、水素化カルシウム (CaH2)がよく利用されます。水素化カルシウムは、LAHやNaHなど比べると反応性が低いため安全です。
水素化カルシウムはTHFやジエチルエーテルなどのエーテル系溶媒、酢酸エチルなどのエステル、ピリジン、トリエチルアミンなどのアミン類、ヘキサンやベンゼンなどの炭化水素類、ジメチルスルホキシド、ジメチルホルムアミドに加え、アルコール類(tBuOHやエタノール)など多くの有機溶媒の乾燥に適しています。
 こめやん
こめやん
水素化カルシウムのつぶしかた、後処理、クエンチ法
水素化カルシウムは結構大量に使うことが多く、何も考えずに水に加えたりすると危険です。
水素化カルシウムの使用量がミリグラムスケールであれば、氷を反応容器に加えて撹拌することでクエンチできます。アルコール類では反応が遅く効率的にクエンチできません。
グラムスケールの場合は、大量の氷に水素化カルシウムを少しずつ加える方法があります。水に入れるよりも安全につぶすことができます。大量にある場合はカルハイに水や氷を加えるのは危険なのでやめましょう。潰す作業中は大量の水素ガスと熱が発生するので必ずドラフト内で行い、少量ずつクエンチしましょう。
あまりにも大量に廃棄の水素化カルシウムがある場合は、廃棄用の瓶の灯油中に保存して、業者に引き取ってもらったほうが安全です。
水素化カルシウムの反応例
水素化ナトリウムなどのように塩基として利用されることは少ないようです。系中に発生する水分の脱水剤としても利用されることがあります。
- アセタール化反応
- エステル化、アミド化
- マイケル付加反応
などがあります。