カイザーテストとは?
カイザーテストはペプチド固相合成法を行ったときにレジン上に未反応のアミノ基が存在しているかどうか?を着色によって判断するためのテストです。おもに色調の変化はアミノ基とニンヒドリンとの反応により生成するルーエマン紫によるものです。
カイザーテストは信頼性を高めるために最適化されており、ピリジン、フェノール、シアン化カリウムなどが加えられているのが特徴です。
反応機構を見るとアミノ酸との反応により最終的にルーエマン紫が生成するまでに可逆的過程があることが分かります。
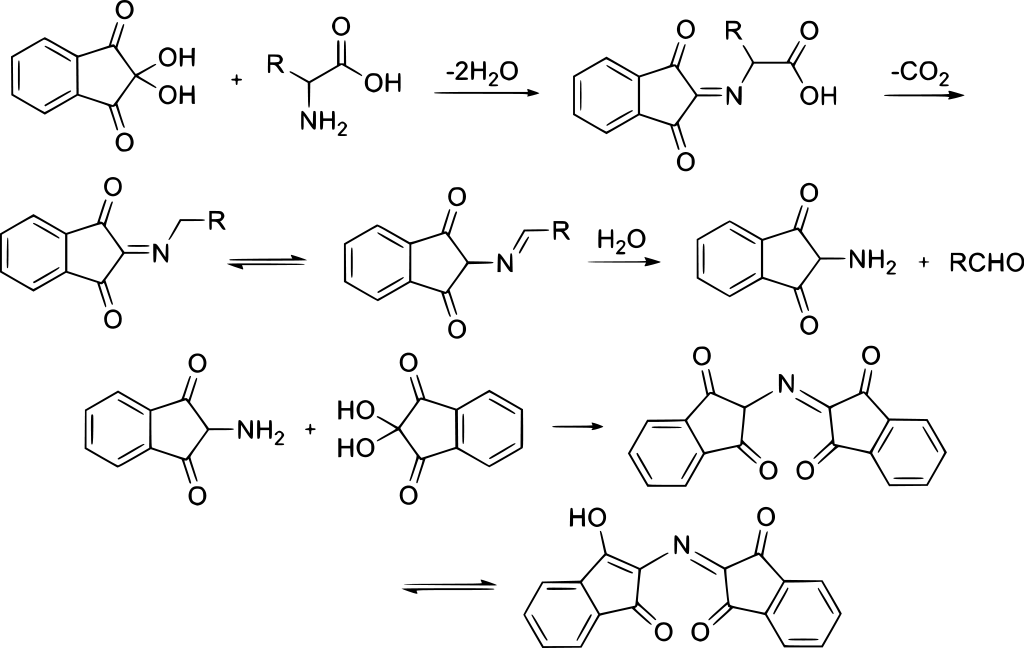
Image from wikipedia public domain
溶媒条件を検討した結果、フェノール/ピリジン溶媒が最も迅速にルーエマン紫を形成しやすいことが分かりました。アミンとニンヒドリンとの反応はpH=5くらいが最適みたいです。
シアン化カリウムは還元剤として加えています。アスコルビン酸よりも安定なため選択されています。
Troll, Walter, and R. Keith Cannan. “A modified photometric ninhydrin method for the analysis of amino and imino acids.” Journal of Biological Chemistry 200 (1953): 803-811.
カイザーテスト試薬のレシピ
カイザーテストの試薬は3つの溶液からなります。
- ニンヒドリン溶液
- KCNピリジン溶液
- フェノール溶液
です。
1.ニンヒドリン溶液のレシピ
ニンヒドリン1.0gに対して20mLのブタノールを加えます。
2.KCN溶液のレシピ
16.5mgのKCNと25mLの蒸留水を加えて溶液とします。この溶液1mLを49mLのピリジン溶液で希釈します。
3.フェノール溶液のレシピ
40gのフェノールを20mLのブタノールで溶かします。
作った3つの溶液は混ぜないでそのまま別々に利用します。
カイザーテストのやり方
レジンへのアミノ酸の縮合反応が終わり洗浄後、にキャピラリーで視認できる量のレジン(数粒~十数粒)をとります。
ガラス製のマイクロチューブなどにキャピラリーごと入れて、カイザーテスト試薬を2~3滴ずつ加えます。
110℃に熱したブロックヒーターやオイルバスなどで5分加熱しまs。
色を確認してビーズの色が紫に変色している場合はまだ反応点が残っているのでもう一度縮合しましょう。
プロリンなどのイミノ酸は紫にならないので注意します。別の検出方法を利用したほうが良いかもしれません。アスパラギン、アスパラギン酸、セリンも見にくいらしいですが、個人的にはきちんと視認できました。
リファレンスとしてFmoc脱保護前のレジンをとっておくと色の変化が起きているかどうかがわかりやすくなります。
どうにもアミノ酸がカップリングできない場合はキャッピング処理します。
Wellings, D. A.; Atherton, E. “Methods in Enzymology Volume 289: Solid-Phase Peptide Synthesis”Ed. Fields, G. B. Academic Press, San Diego, 1997, p. 54