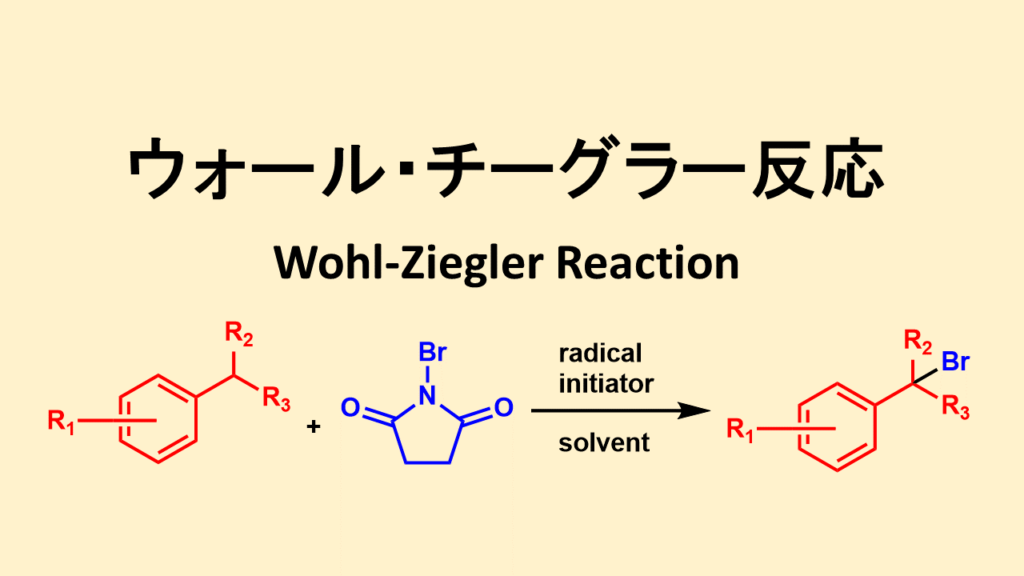
ウォール・チーグラー反応はNBSを用いたアリル位、ベンジル位選択的な臭素化反応です。
1919年にA. WohlによりN-ブロモアセトアミドによるアルケンの臭素化が発見され、1942年K. ZieglerはN-ブロモスクシンイミド(NBS)を用いたアリル位臭素化を行い、さらにPKarrerにより触媒量の過酸化ベンゾイルが反応速度の増大に有用であることが発見されたことにより有用な臭素化方法として合成反応に利用されるようになりました。
ウォール・チーグラー反応について
NBSを用いたオレフィンのアリル位あるいはアルキル化された芳香族、またはヘテロ環芳香族化合物のベンジル位への臭素置換基の導入はWohl-Ziegler臭素化として知られています。
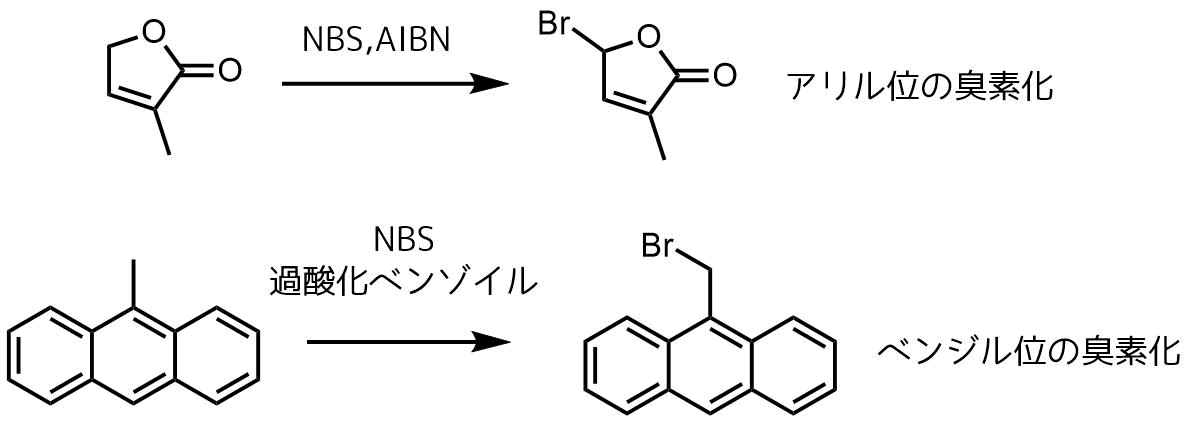
ウォールチーグラー反応
アリル位やベンジル位の臭素化は臭素単体をそのまま使用する方法もありますが、臭素は有毒で扱いにくい欠点があります。NBSは取り扱いやすいため、代替法として優れています。選択性も高いため有機合成では重宝されています。ウォール・チーグラー反応では通常ラジカル開始剤として5-20 mol%のAIBNや過酸化ベンゾイルなどを添加します。ラジカル開始剤は加えなくても還流するなど熱をかけたり、光などでも反応が進行するため、NBSと溶媒だけでもOKです。
ラジカル開始剤としてはより低温で作用するAIBNのほうが優れていますが高価です。
ウォール・チーグラー反応の特徴
ウォール・チーグラー反応の特徴は有毒で取り扱いにくい臭素を使用せずとも臭素化が可能なところです。NBSによる臭素化は選択性も高く、副反応も少ないです。
NBS(N-ブロモスクシンイミド)は市販されている反応剤であり、光と反応するため、暗いところで湿気を避ければ安定に保存できます。
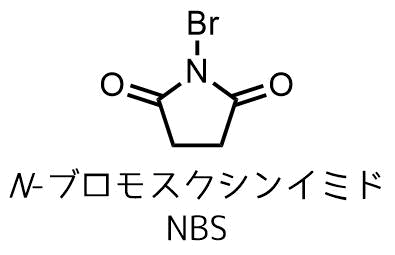
NBSの構造
臭素化は選択性が高く進行しますが、塩素化は困難です。アリル位の直接的なハロゲン化は臭素化を使います。
選択性
ウォール・チーグラー反応の特徴の一つは高い選択性です。
オレフィンが二つのアリル位をもつ場合、より多くのアルキル置換されたアリル位(より安定なアリルラジカル)での臭素化が優先します。
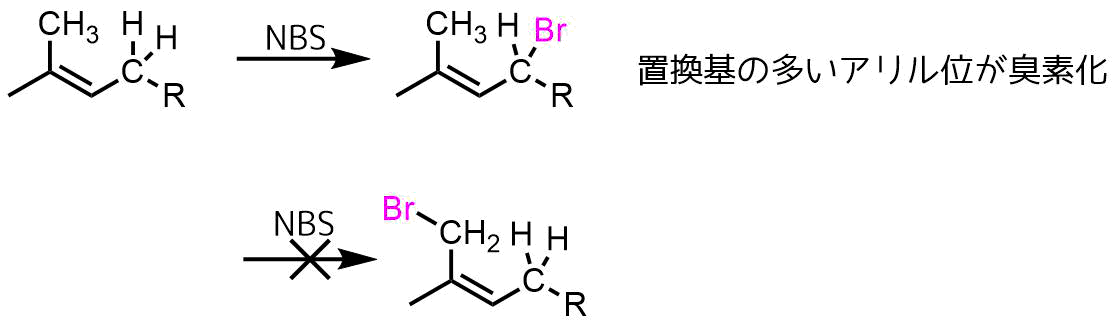
アリル位臭素化の選択性
芳香族のベンジル位は臭素化されやすいため、芳香環への臭素化よりもベンジル位の臭素化が優先されます。
しかし、電子豊富な芳香環、アルコキシ基のオルト位などはベンジル位の臭素化よりも芳香環の臭素化が進行する場合もあります。
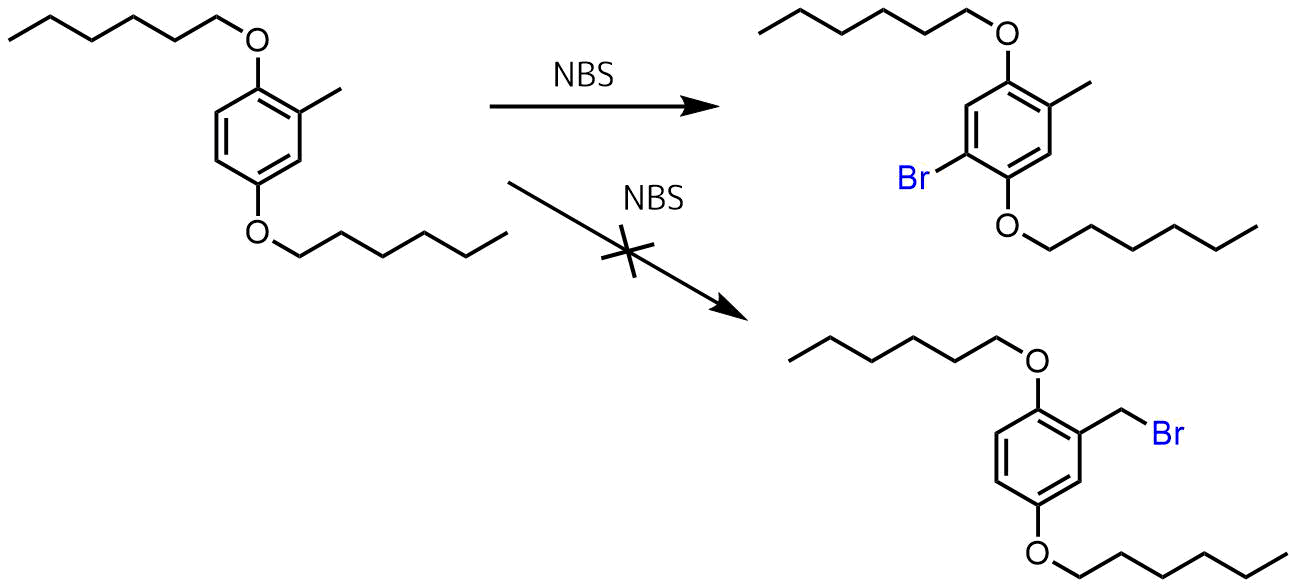
Norris, Benjamin N. et al Macromolecules , 46(4), 1384-1392; 2013
反応機構
Wohl-Ziegler臭素化の機構は臭素ラジカル(イミドイルラジカルではない)が関与しています。
ラジカル開始剤は熱または光の照射により均一に開裂し、それが臭素(常にNBS内に少量存在)と反応して臭素ラジカルを発生します。そして、アリル(またはベンジル)位から水素原子を引き抜きます。
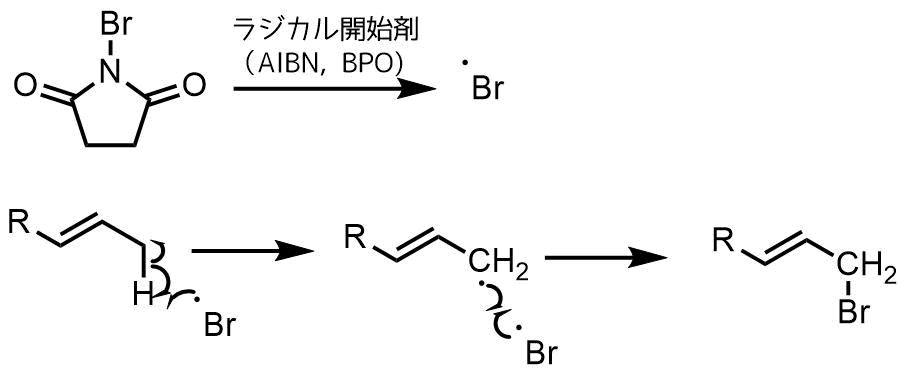
NBSの反応機構
生成する臭素ラジカルから臭素、副生物として臭化水素が生成し、これらがアルケンの二重結合に付加する副反応が起こる可能性があるため、濃度を薄くしたほうが副反応を抑えることができます。
実験手順
ウォール・チーグラー反応の操作手順、反応条件は簡単です。NBSとラジカル開始剤を加えて攪拌するだけです。
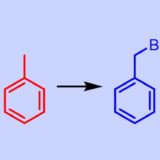
ベンジル位の臭素化
NBSの量は加えすぎるとジブロモ体が得られたり意図しない臭素化が起こることがあるので注意します。
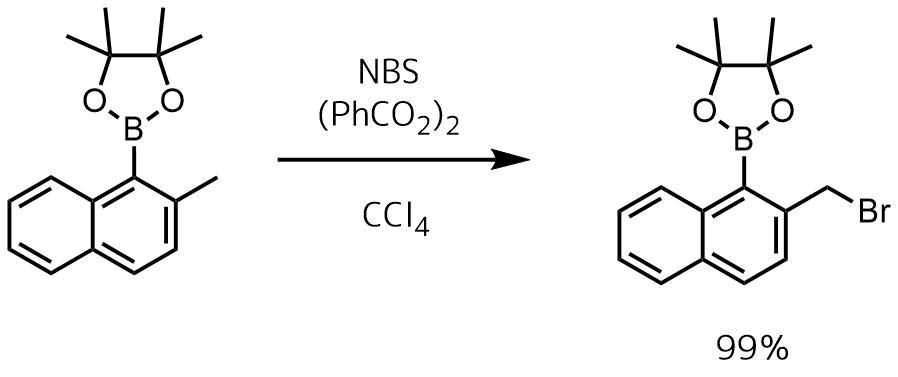
Hagadorn, John R. and Ganesh, Renuka N. US., 20110224391, 15 Sep 2011
176 mmolの基質と185mmolのNBSおよび340mLのCCl4に溶解し、0.7 mmolの過酸化ベンゾイルを加えて75℃で14時間撹拌した。反応後、室温に冷やしてろ過して濃縮、目的物を99%で得た。
NBSはジブロモ体の生成を抑えるため、1.05当量などほぼ1当量くらいの量で加えます。反応は加熱還流を行うことが多く、基質によっては室温でも反応が進行します。NBSの反応は発熱反応であり、急激な発熱により反応が暴走することもあるので、0℃で加えたり、徐々に温度を高くして様子を見ながら加熱したほうが良いかもしれません。類似の基質がどのような条件で反応が進行しているかを調べて予測を立てておきましょう。
反応後に生じるベンジルブロミドは反応性が高いため、分液やカラム精製などは行わないで次操作を行ったほうが良いこともあります。
溶媒は溶解する場合は沸点が高めで不活性な四塩化炭素を使うことが多く、熱をかけなくても良さそうな場合はジクロロメタンを使います。その他にはクロロホルムやベンゼン、アセトニトリル、THF、1,2-ジクロロエタンも使用可能です。
ジブロモ体が欲しい場合はNBSを2当量用います。逆にジブロモ体の副生を抑えたい場合はNBSを1当量以下にしてオレフィンを小過剰用います。

記事の末文にジブロモ体の副生を抑えるにはオレフィンを小過剰投入とありますが、これは合成に用いる基質が芳香族化合物の場合、その基質を1.1当量程の量に変えるという認識でよいのでしょうか?
はい。表現がnbsを0.9など少なめにすると言う方が適切だったかもしれません。
基質が貴重であれば、ジブロモ体はできるだけ抑えたいので、nbsを1当量以下にして未反応原料を回収、再利用するという考え方です。
基質の反応性によってはもっと加える必要があるかもしれません。
通常の合成感覚で反応剤のnbsを1.1〜2.0当量入れるとジブロモ体生成で基質を失う可能性があるので注意しましょうと言うくらいの感覚で書いてます。