マクロライド系抗生物質とは?
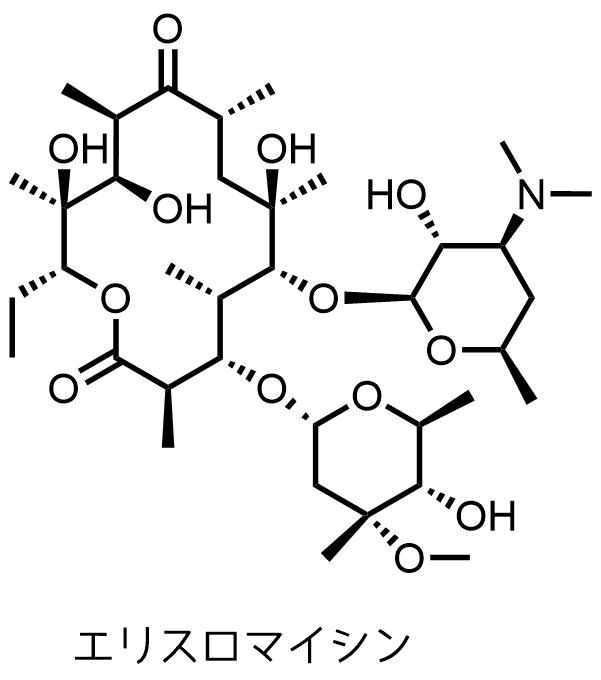
マクロライド系抗生物質は大環状ラクトンと1つ以上のデオキシ糖からなる物質で細菌や真菌の増殖を抑制する効果があります。
代表的な抗生物質であるペニシリン(βラクタム系)が殺菌的に働くのに対してマクロライドは増殖を抑える「静菌的」に働きます。
厚生労働省の第5回NBDオープンデータによると主としてグラム陽性菌,マイコプラズマに作用する抗菌薬(外来・院外処方、内服薬)として最も良く処方されるものはクラリスロマイシンで次いでエリスロマイシン、アジスロマイシンです。
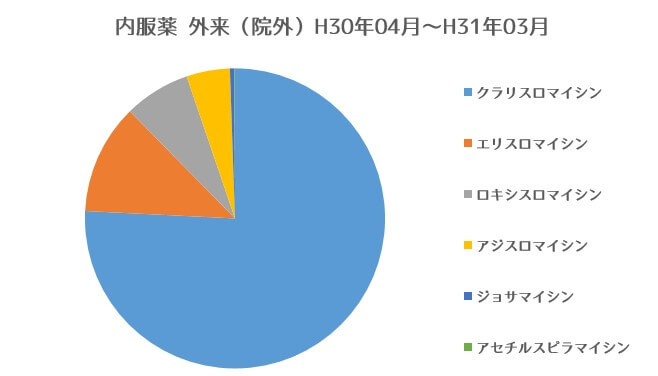
厚生省 第六回NBD opendata https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000177221_00008.html
マクロライド系の特徴
マクロライド系抗生物質の特徴は以下のようなものがあります。
- 静菌作用(細菌を殺菌するのではなく増殖を抑制する作用)
- ペニシリンアレルギー患者への代替
- 各種抗生物質の耐性菌に対する代替
- 副作用が低い(急性・慢性毒性が少ない)
- 中程度の抗菌スペクトル(ペニシリン系に類似)
- グラム陽性細菌に対する効果(肺への移行性の高さ)
マクロライド系の抗生物質は古くから利用される医薬品で実績があります。
主に肺炎球菌や黄色ブドウ球菌といったグラム陽性菌によく効き、安全性も高いことから良く処方されていました。しかし、近年は濫用により薬剤耐性化が進み、A群溶血性レンサ球菌、肺炎レンサ球菌、ヘリコバクターピロリなどで使用しにくくなっています。
マクロライドの分類
マクロライド系抗生物質は大きく2つに分けられます。
- マクロライド類
- ケトライド類
マクロライド類はエリスロマイシンなどの最も一般的なマクロライド系抗生物質の分類です。ほとんどがこのマクロライドに分類されます。
ケトライド類は新しいマクロライド系抗生物質の分類で糖が結合しているエーテル結合がケトンに変換されている物質の1群で従来のマクロライドに対して耐性のある菌に対しても有効で、抗菌スペクトルも広い点で有用ですが、副作用などの面で日本で唯一利用できたテリスロマイシン(ケテック)は販売終了になっています。
マクロライドは環サイズによる分類も可能です。
- 14員環 – エリスロマイシン、クラリスロマイシン、ロキシスロマイシン
- 15員環 – アジスロマイシン
- 16員環 – ジョサマイシン、ロキタマイシン、ミデカマイシン
16員環のマクロライドは抗菌活性が14員環と比べて弱いですが胃腸障害などの副作用が少なく安全性が高いです。苦みも少ないので小児への処方にも使いやすいです。
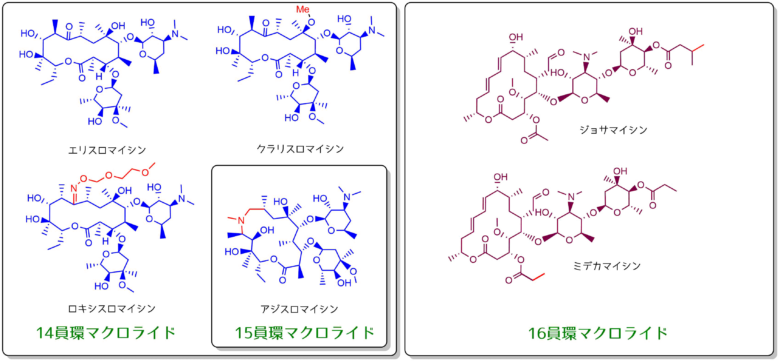
マクロライド系抗生物質
時々ペニシリン系やテトラサイクリン系などの他の抗菌薬と併用することがあります。
抗菌作用のメカニズム
マクロライド系抗生物質は細菌特有のリボソームの働きを阻害することによって抗菌作用を示します。
マクロライドは細菌のリボソーム50SのサブユニットPに可逆的に結合します。ケトライドも同様です。マクロライドがリボソームに結合することによってtRNAの結合が阻害され、細菌のタンパク質合成が阻害されます。これにより細菌は増殖できなくなります。
リボソーム50Sは細菌にしか存在しないため真核細胞のリボソームには作用しないため毒性が極めて低いです。
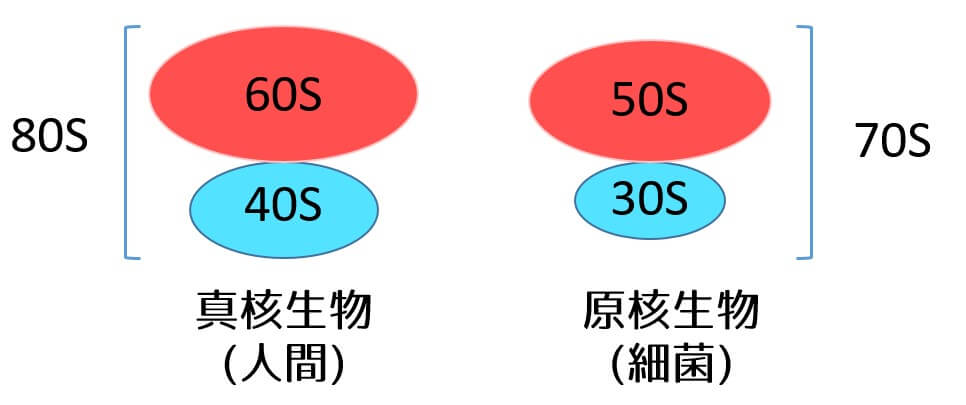
細菌と人間のリボソーム
マクロライドは白血球内に蓄積するため感染部位に輸送される効果があります。
構造活性相関
マクロライドはアグリコンの大環状のラクトン環と糖(デソサミン、クラジノース)からなる配糖体です。
エリスロマイシン (EM)
14員環マクロライドで、最も古い
- 胃酸で分解されやすい(空腹時に飲むのがよい)
- 半減期が短い
- 消化器に対する副作用が強い(下痢)
- グラム陰性杆菌に無効
- 耐性誘導しやすい
- CYP阻害作用(薬物併用に注意)
- 安価(gあたりCAM・2.5倍、AZM・6.5倍)
1952年発見、1953年発売されています。エリスロマイシンはStreptomyces erythreusにより生産される物質です。

多くのマクロライド系抗生物質がこのエリスロマイシンをもとに開発されています。
エリスロマイシンはウッドワードにより全合成が達成されていますが、一からの合成は困難であるため微生物から産生されたエリスロマイシンを原料として生産されています。
ウッドワード博士 By Peter Geymayer / (Original text: Dr. Peter Geymayer) -PD
Woodward, R. B., et al. “Asymmetric total synthesis of erythromycin. 3. Total synthesis of erythromycin.” Journal of the American Chemical Society 103.11 (1981): 3215-3217.
当初はグラム陽性菌に聞くという触れ込みで呼吸器疾患(肺炎球菌)、黄色ブドウ球菌(後に耐性化)マイコプラズマなどにも利用されていました。
エリスロマイシンは後発のマクロライド剤と比べて欠点が多いですが、びまん性汎細気管支炎(DPB)に対する少量長期療法ではエリスロマイシンが第一選択で利用されています。
アジスロマイシンやクラリスロマイシンはエリスロマイシンの胃腸障害等の副作用や低吸収性を改善するために構造を一部改変して開発された薬剤です。
酸には不安定でpH1, 37℃, 5minで97%以上が分解するという報告があります。
クラリスロマイシン(CAM)
1991年発売された14員環マクロライドでエリスロマイシンよりも優秀な特徴を有する
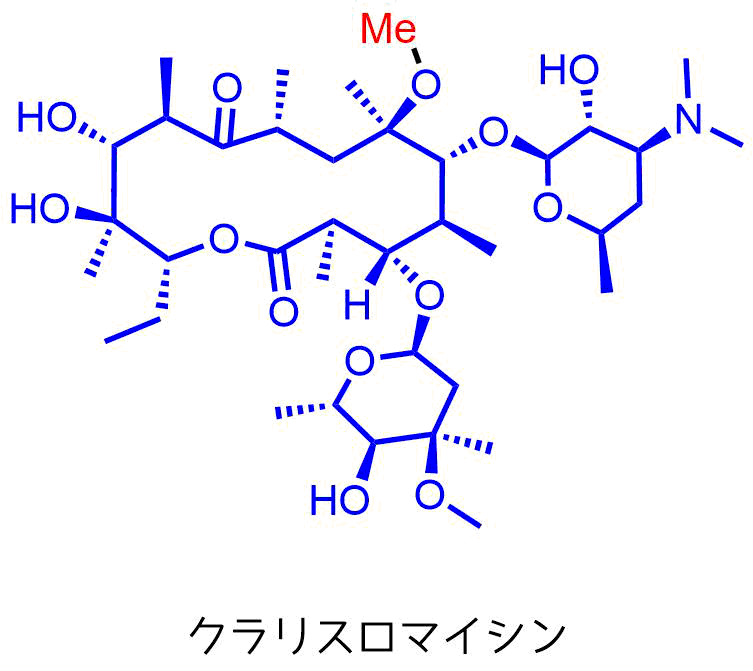
クラリスロマイシンの構造
クラリスロマイシンはエリスロマイシンの弱点である
- グラム陰性菌に対する弱い抗菌活性
- 酸に対する安定性
- 低吸収性
を改善する目的でマクロライド環6位の水酸基をメトキシ基に変換しています(詳細はこちら)。
1. Hardy, Dwight J., David RP Guay, and Ronald N. Jones. “Clarithromycin, a unique macrolide: a pharmacokinetic, microbiological, and clinical overview.” Diagnostic microbiology and infectious disease 15.1 (1992): 39-53.
クラリスロマイシンの特徴
- グラム陰性菌(インフルエンザ菌等)に対する活性が向上(対EM)
- 胃酸に対する安定性が高い
- 吸収が良い(食事とともに摂取するとよい)
- 組織・細胞に移行しやすい
- CYP阻害作用(薬物併用に注意)
クラリスロマイシンのバイオアベイラビリティはエリスロマイシン25%以下に対して55%と高いです(アジスロマイシンは37%)。疎水性向上により組織や細胞に浸透しやすくなっています。
LeBel, Marc. “Pharmacokinetic properties of clarithromycin: a comparison with erythromycin and azithromycin.” Canadian Journal of Infectious Diseases 4.3 (1993): 148-152.
ロキシスロマイシン (RXM)
ロキシスロマイシンは14員環マクロライドでエリスロマイシンの9位のカルボニル基をオキシムに変換した半合成マクロライドで、1987年に承認されました。
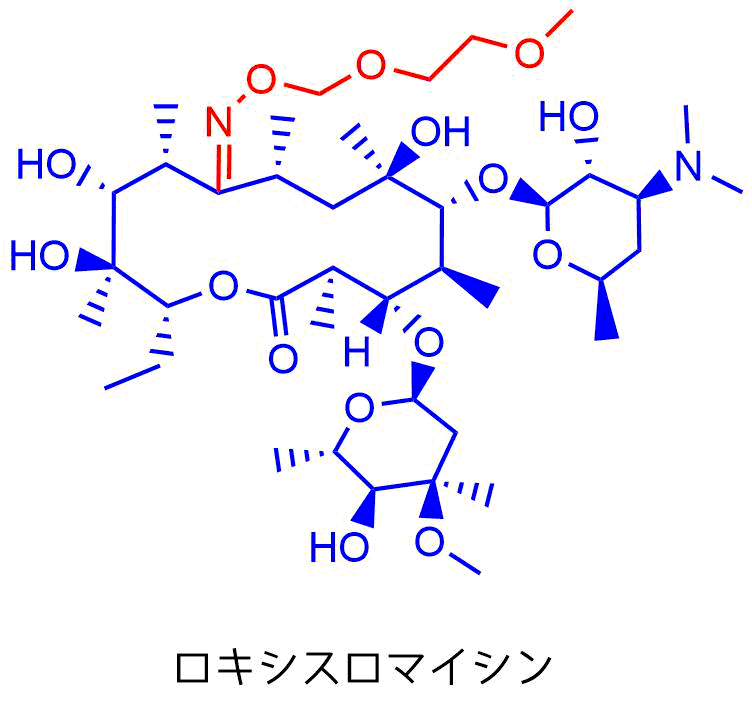
ロキシスロマイシン
カルボニル基をオキシム(N=O)に変換することで酸への安定性が向上しています。また、P450に対する親和性も低いため薬物相互作用が小さいのも特徴です。EMと比べて抗菌活性はやや低いですが薬物動態は改善されており高い血中濃度が得られます。
アジスロマイシン(AZM)
15員環マクロライド。1980年にPliva社によって見出され、1988年に医療用として承認されました(日本では2000年と遅い)。マクロライド環中に窒素を含むためアザライドと呼ばれることもあります。唯一の15員環マクロライドです。
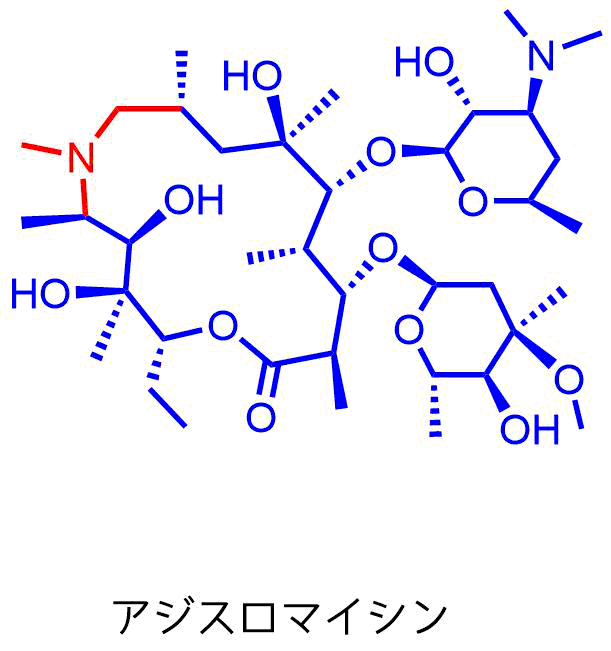
アジスロマイシンの構造
アジスロマイシンの特徴
- グラム陰性菌に対する効果が強化
- 酸に対する安定性が高い
- 薬物相互作用が少ない(CYP阻害作用しにくい)
- 組織・細胞移行性が高い
- 長い半減期
グラム陰性菌に対する抗菌作用が強化、酸に対する安定性も14員環よりも高いが、消化管障害は同程度
肝臓代謝系に作用しにくく、P450 にも結合しないので薬物相互作用はあまり気にしなくても良い。テオフィリン代謝にも14員環とは異なり作用しない
組織移行性が高い、組織内濃度半減期が60~80時間と非常に長いため、1日1回3日間投与(500mg * 3日、1g・1日、2g・1日)など服薬期間は短くて済み、服薬中止による耐性化も起こりにくいといわれています。
アジスロマイシンは他のマクロライドと比べてメリットが多いですが、薬価は高いです。クラリスロマイシンは1/3、エリスロマイシンは1/8です。ただし、AZMは投与量、服薬期間は短いです。
アジスロマイシンはマクロライド環内の9位と10位の間に窒素原子を導入することにより組織移行性と胃酸に対する安定性を向上させています。
クラリスロマイシンでは求核部位のアルコールを保護したのに対してアジスロマイシンでは求電子部位のカルボニルを除去するアプローチがとられています。
ファゴサイトデリバリーといってAZMが白血球に取り込まれやすいため、感染病巣にAZMが白血球に運ばれて集中的に作用する特徴があります。
副作用について
アジスロマイシンは副作用が少なく安全性が高いといわれていますが半減期が長く、下記の症状に対して1g~2gの大量単回投与という形がとられることも多いです。
- 急性気管支炎
- 急性咽頭炎
- 急性副鼻腔炎
大容量の単回投与は一回の服薬で済むため、飲み忘れや自己判断による服薬中止による薬剤耐性化の防止にも役立ちます。
その一方で副作用が発現した場合には大量摂取かつ長期間薬効が続くため、副作用の影響も長時間続く可能性があります。
アジスロマイシン主な副作用は下痢でこれらの消化器系有害事象は食後よりも空腹時に投与したほうが軽減されるという報告があるため空腹時の摂取が良さそうです。
こうした副作用は基本的には服薬後2~3時間に発現する一過性の下痢症状で軽度のものが多いので過度な心配はいりません。
- 二木芳人, et al. “患者アンケートによるアジスロマイシン 2g 単回投与製剤服薬満足度調査報告.” The Japanese journal of antibiotics 63.4 (2010): 291-298.
マクロライド系抗生物質は消化管の蠕動運動を促進させるホルモンであるモチリン受容体に対するアゴニスト作用が認められています。これが下痢を引き起こす原因であると考えられています。
16員環マクロライド
ジョサマイシン(1967年)、スピラマイシン、ロキタマイシン(1981年)、ミデカマイシン(1971年)は16員環マクロライドに分類されます。エリスロマイシンを第一世代とすると16員環マクロライドは第二世代といえます。
16世代マクロライドはエリスロマイシンよりも吸収性や代謝安定性に優れています。耐性誘導されにくく、薬物相互作用もEMと比べて小さく、副作用も少ないため、エリスロマイシンの代替として用いられていましたが最近はCAMやAZMといった第三世代のニューマクロライドが代わりに使用されています。
ケトライド
テリスロマイシンなどのケトライドの特徴は作用点が異なるため現在マクロライド耐性の菌に対しても有効である点です。
明石敏. “マクロライド系抗菌薬を中心に.” 日本薬理学雑誌 130.4 (2007): 294-298.
その他のマクロライド系抗生物質
バリノマイシン
バリノマイシンは12個のアミノ酸からなる大環状抗生物質です。
バリノマイシンの特徴はイオノフォアとしての機能です。カリウムと特異的に結合しカリウムイオンの能動輸送を行います。バリノマイシンは中性アミノ酸からなる大環状化合物でエステルとアミド結合でつながっています。
中性でカリウムイオンを補足するようなものとしては、クラウンエーテルがあります。
耐性化機構
これまで有効だった微生物が変異によって効かなくことを耐性化といいます。抗生物質につきものな問題で抗生物質の安易な使用や治療途中での服薬中止などが耐性菌出現の原因と考えられています。
耐性化とは薬物が効かなくなることですがそのメカニズムは多岐にわたります。
- 酵素分解(EMエステラーゼ、マクロライド-2′-リン酸化不活性化酵素)
- 結合サイトの変異(リボソームRNAのアデニンジメチル化等)
- 細胞外排出機構(細胞外にマクロライドを輸送して細胞内マクロライドの濃度を低下させる)
酵素分解
細菌によって生産される酵素によってマクロライド抗生物質が不活性な構造に変換する機構です。エステラーゼでラクトン環が開環したり、糖のリン酸化により不活性化されます。
結合サイトの変異
リボソームはタンパク質とRNAの複合体です。リボソーム中のリボソームRNAのアデニン残基N6メチル化酵素によってジメチル化するとマクロライドが結合できなくなり、抗菌作用が失われます。強く相互作用する部位の変化あるいは立体構造の変化等
細胞外排出機構
細胞外にマクロライドを特異的に排出するポンプはマクロライドを産生する細菌中にも見られます。一般的にそれらはABCトランスポーターに属します。細菌にとって毒であるマクロライドを吐き出すような感じです
1. 小原康治. “今日のマクロライド系抗菌薬の耐性化の傾向.” 日本化学療法学会雑誌 48.3 (2000): 169-190.
参考
- 松森浩士. “マクロライド系抗菌薬の現状と展望.” 歯科薬物療法 20.2 (2001): 69-77.
- 中島良徳. “抗生物質マクロライドの魅力.” 日本細菌学雑誌 50.3 (1995): 717-736.
- 砂塚敏明. “マクロライド系薬の新作用と創薬.” 日本化学療法学会雑誌 52.7 (2004): 367-370.
- 清水喜八郎, 小林宏行, and 谷本普一. “《 座談会》 マクロライド系抗生物質の最近の動向 Clarithromycin を中心として.” The Japanese Journal of Antibiotics 47.9 (1994): 1091-1106.
- Hardy, Dwight J., David RP Guay, and Ronald N. Jones. “Clarithromycin, a unique macrolide: a pharmacokinetic, microbiological, and clinical overview.” Diagnostic microbiology and infectious disease 15.1 (1992): 39-53.