化合物に官能基を導入したり、化合物の状態を予測する際に、その官能基の電子的な効果を予測できれば、反応自体の進行や化合物を応用するのに便利ですよね!
そんな便利な尺度を実際に調べてみようと考えたのがL.P.ハメット(L.P.Hammett)で、そのハメットが発見した関係測のことをハメット測(Hammett equation)と言います。
ハメット測の概念
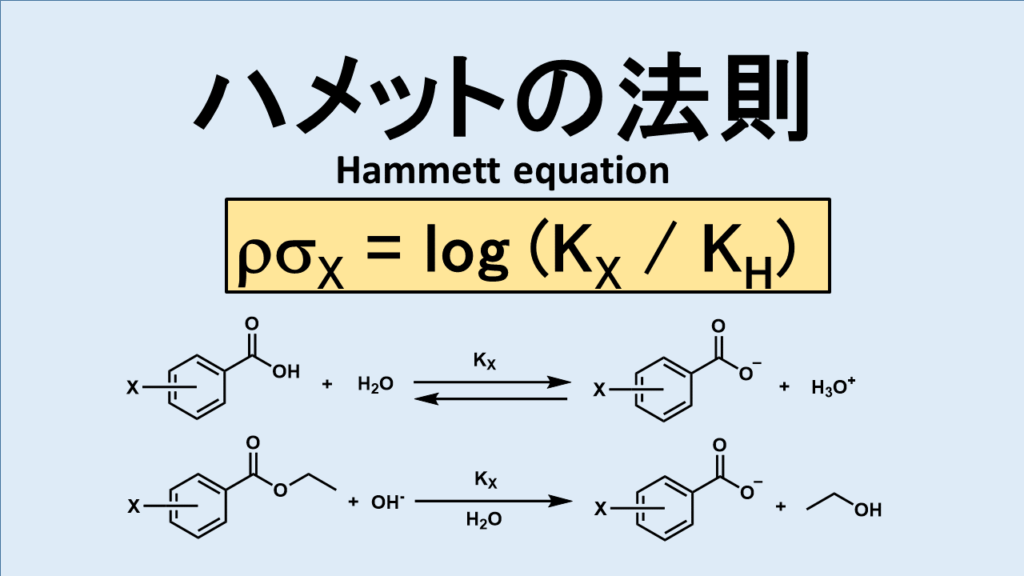
ハメットは官能基の電子的効果を測定するために酸性度(pKa)を尺度にしようと考えました。そしてそれが化合物の反応と相関関係があるのか調べてみました。その結果、m-置換およびp-置換安息香酸において、下のような関係測を発見しました。
ρσx = log[ Ka(R-安息香酸) / Ka(安息香酸) ]
上の式は簡単に表すと
ρσx = pKa(R-安息香酸) – pKa(安息香酸)
になります。単純に置換基が入った安息香酸から何も入っていない安息香酸のpKaを引いたら出ちゃうんですね。
次にこのσ(シグマ)、ρ(ロー)がそれぞれどういう意味と役割を持つのかについて説明してみます。
ハメットの置換基定数: σx (シグマ)
ハメット測に出てくる σx はハメットの置換基定数と呼ばれます。これは置換基に特有の固有値になりますが、置換基自体の電子的効果(どれぐらい電子求引なのか電子供与なのか)を表します。
ハメットの式から考えてみる
後でρについては記しますが、ρは反応を比較するときに使うものなので、官能基だけを比較したい場合は、さっきの式で考えた時にρを1とした時の値がそのままσxになります。要するに、この置換基定数を算出するためには
σx = log[ Ka(R-安息香酸) / Ka(安息香酸) ]
σx = pKa(R-安息香酸) – pKa(安息香酸)
を解けば良いのです。ちなみにσx の x には p (パラ)か m (メタ)が入ります。置換基の位置がパラかメタかによって効果が異なるので、それぞれ別の固有値を示します。自分で参考にする際は、調べたいのがパラ位かメタ位か間違えないようにしましょう!
また、この式の分母が安息香酸なので、RがHの場合はσx = 0 になります。これが基準点になるわけですね。すなわち、官能基がHの場合と比較したときの置換基Rが、どれぐらい電子的効果があるのかを数値化したものであると言えます。
そして基準値がHよりも電子的に求引している場合は、安息香酸の酸性度が上がってpKaが小さくなるためマイナスの値を示します。その逆で、Hよりも電子的に供与している場合は、安息香酸の酸性度が下がるのでpKaが大きくなってプラスの値を示します。
ハメットの反応定数: ρ (ロー)
ハメットは酸の尺度であるpKaを使うことで、反応の遷移状態あるいは中間体に対する置換基の電子的効果を定量的に評価すため、反応速度との相関を調査しました。その例としてよく知られているのがエステルの加水分解速度で、これが対応する酸(この場合は安息香酸)のpKaと相関すると考えて、プロットしたところm-,p-置換体で相関関係になることを見つけています。
Hammettの反応定数ρは、電子効果に対する反応の依存度を表しています。