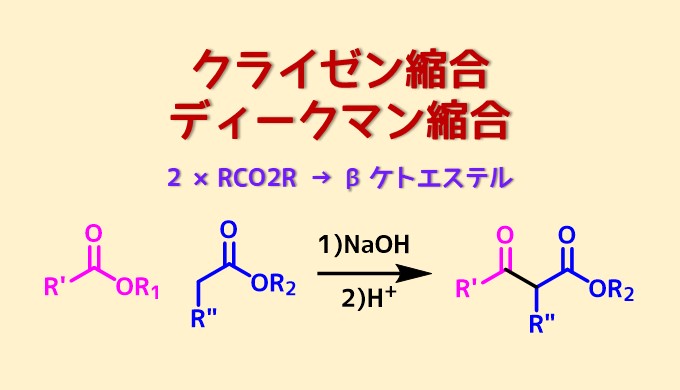
分子内でおこるクライゼン縮合をディークマン縮合と呼びます。エノールを求核種とする点はアルドール縮合と似ています。
目次
クライゼン縮合とは?
クライゼン縮合は塩基性触媒下、α水素を持つエステルとエステル同士が縮合してβ-ケトエステルを生成する反応のことです。
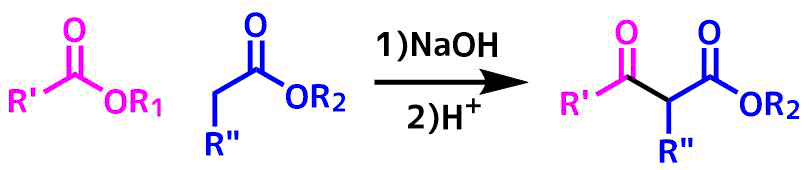
クライゼン縮合の概要
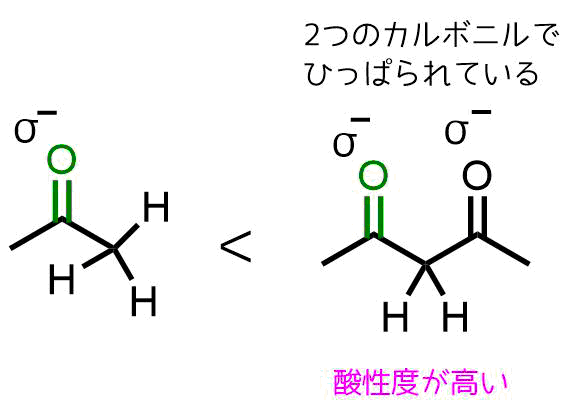
生成したβ-ケトエステルは1,3-ジカルボニル化合物であり、2つのカルボニル基に挟まれた炭素上の水素は酸性度が高くなっています。
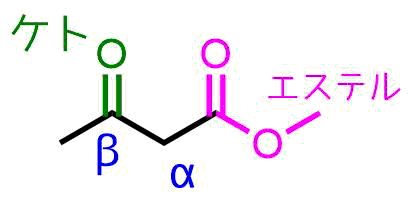
βケトエステル
反応様式は強塩基によるエノールの生成から始まります。次に生成したエノラートがもう一方のエステルのカルボニル炭素に求核攻撃してケトエステルが生成します。したがって、下図のように一方のエステルは引き抜き可能なα水素を持っている必要があります。
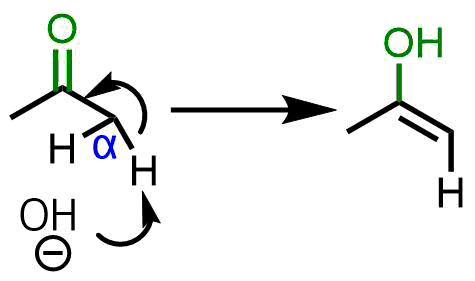
α水素を持つエステルからエノールが生成
エステルはケトン合成の原料には向いていませんが、クライゼン縮合ではエステルを使ってケトンの合成が可能です。
クライゼン縮合の反応機構
クライゼン縮合はエノール可能なエステルのエノール化から始まります(青)。
水酸化ナトリウムなどの強塩基によってエノラートアニオンが生成したのち、これが求核剤となり、別のエステル(桃色)に攻撃します。
これによりケトエステルが生成します。
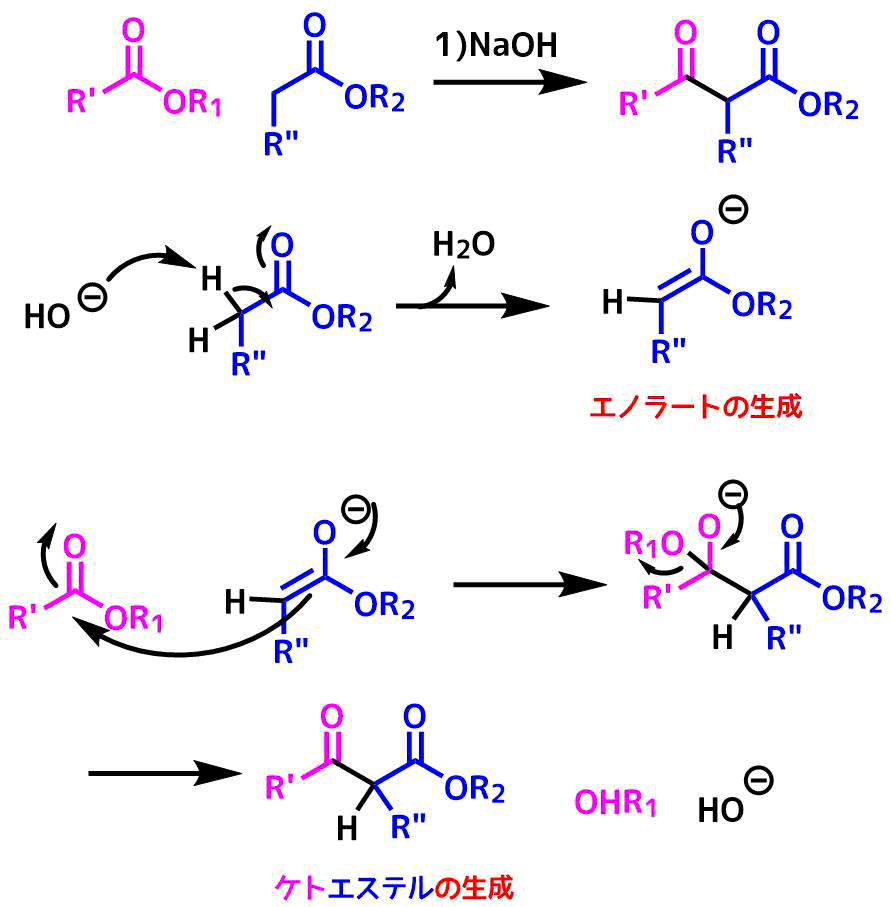
クライゼン縮合の反応機構
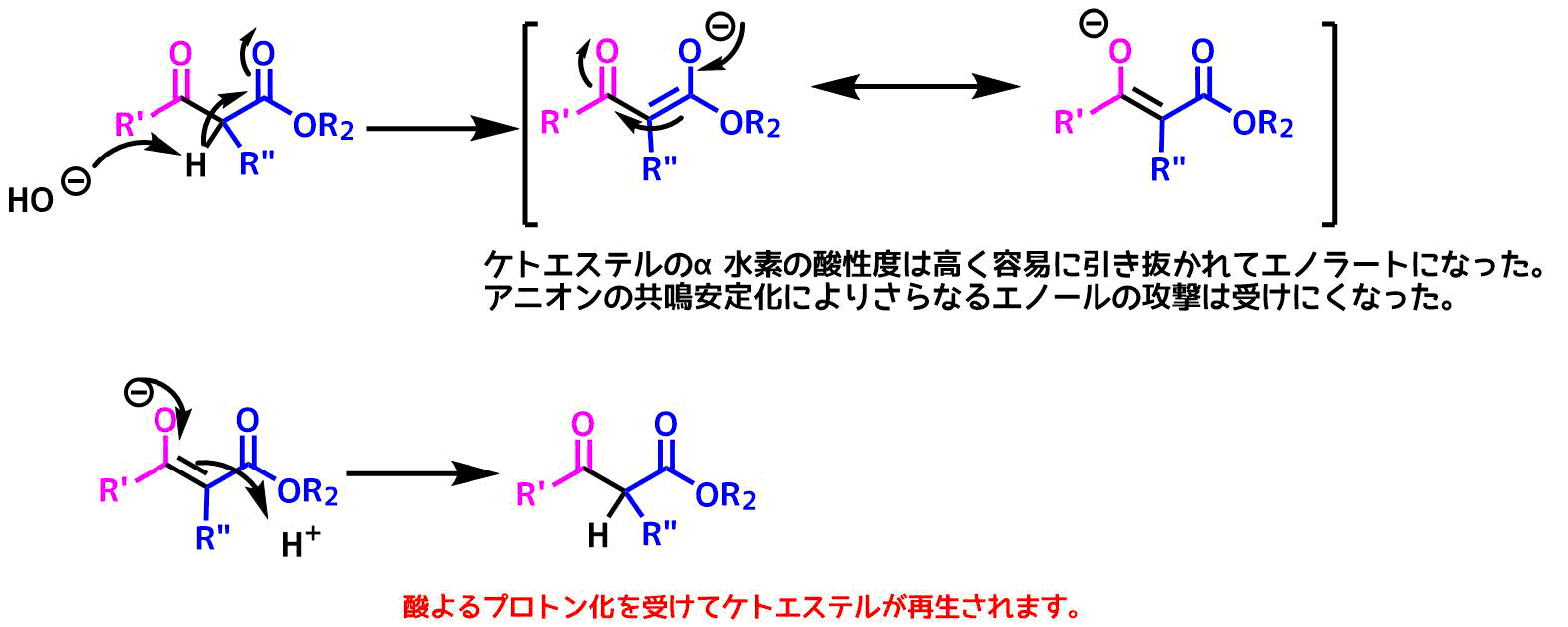
生成したβ-ケトエステエルのケトン(カルボニル基)はエノラートによって再度攻撃されそうですが、停止します。
生成物(βケトエステル)にエノラートが攻撃して過剰反応が起こらない理由
クライゼン縮合により生成したβケトエステルも求核性のあるケトンを持つので反応が起こりそうな気がしますが、実際には進行しにくいです。
その理由は塩基性条件下でβケトエステルはエノールを生成しやすいからです。
α水素の酸性度に着目すれば理由がわかります。
α水素をもつ原料のエステルとβケトエステルとでは、βケトエステルの方が2つのカルボニルをもつことによる誘起効果により酸性度が高くなっています。
アルファ水素の酸性度
さらに生成するエノラートに着目すると2つのケトン間で共鳴構造がかけます。このような共鳴によるアニオンの安定化は誘起効果よりも大きいため、α水素の酸性度は高いと予想できます。
ケトエステルが反応進行しない理由
つまり、エノラートの生成によってケトンの求電子性が低下して攻撃を受けにくくなるため、βケトエステルはさらにエノールの攻撃を受けにくいです。したがってクライゼン縮合では塩基は化学量論量必要です。
最終的にβケトエステルを得るには酸を加えてエノラートをプロトン化します。
ちなみに、このクライゼン縮合の例ではエノール化するエステルとエノール化しないエステルを用いていますが、このように別々のエステルを用いる方法を交差クライゼン縮合といいます。
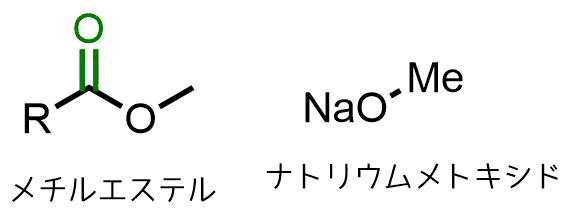
塩基にナトリウムメトキシドやナトリウムエトキシドを使う理由
クライゼン縮合ではエステルを構成するアルコールのアルコキシドを塩基として利用することが多いです。
メチルエステルならナトリウムメトキシド
その理由はエステルの分解によりカルボン酸や別のエステルが生成するのを防ぐためです。
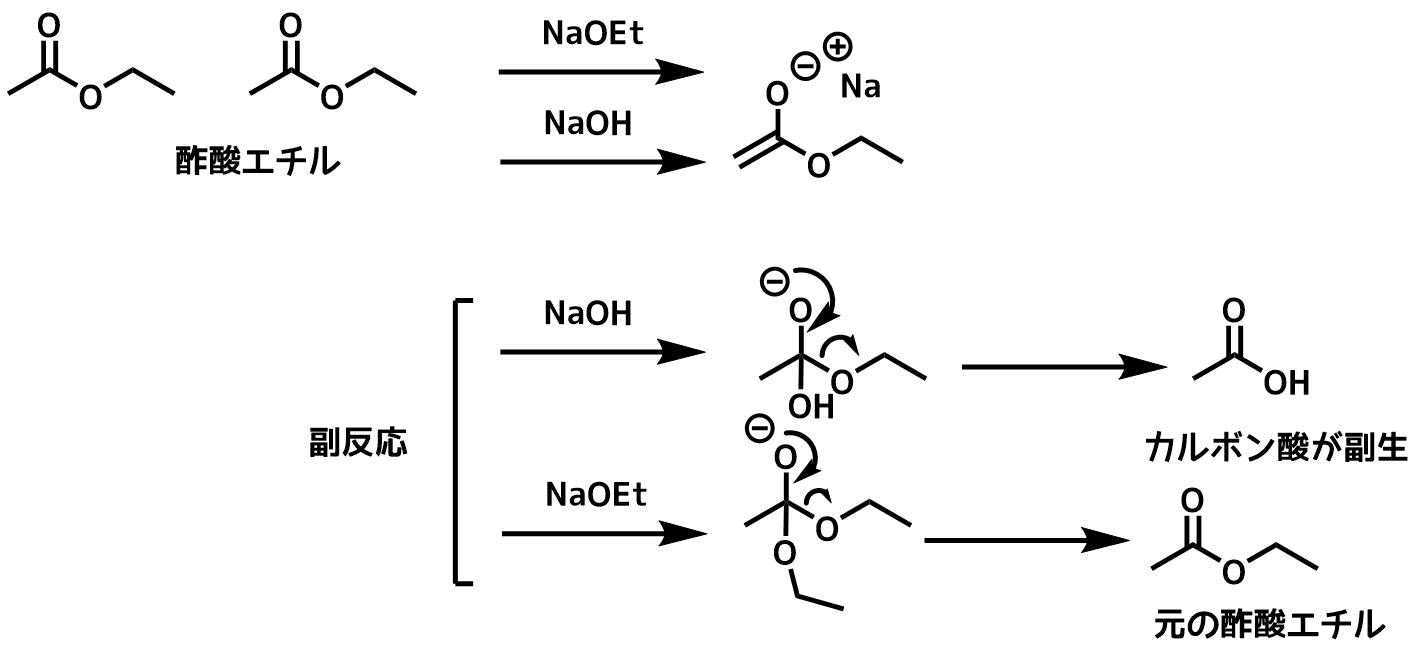
例えば、酢酸エチルのクライゼン縮合を水酸化ナトリウムで実施する例を考えてみましょう。
酢酸エチルのエノール化はナトリウムエトキシドでも水酸化ナトリウムでも進行します。
一方で、エステルに塩基が求核攻撃した場合、水酸化ナトリウムではカルボン酸に分解してしまいます。
もしも、ナトリウムエトキシドを利用していればエステルに攻撃してもカルボン酸には分解せずに酢酸エチルが再生されます
ナトリウムエトキシドを使うと副反応が抑えられる
アルコキシドを使えば副反応を抑えることができるか?というとそういうわけではありません。
もし、ナトリウムメトキシド(NaOMe)にしてしまうと、副反応を起こすとカルボン酸は生成しませんが酢酸メチルが生成してしまいます。
したがってこのようなことが起こらないように、メチルエステルの場合はナトリウムメトキシドを用いて、エチルエステルはナトリウムエトキシドを使います。
ちなみに酢酸エチル同士のクライゼン縮合では「アセト酢酸エチル」が生成します。
エステルとケトンを用いるクライゼン縮合
エノール化可能なケトンとエステルを用いることにより1,3-ジケトンを合成することもできます。
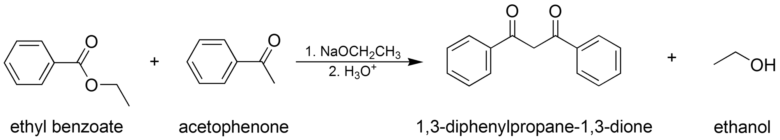
ケトン(エノール)とエステル(α水素無し)との間のクライゼン縮合 from wikipedia by Jesse CC3.0
この時エステルもエノール化可能なものを選択してしまうと複雑な混合物を生成してしまいます。また、この場合でもケトンは反応性が高くケトンエノラートとケトンが自己縮合してしまうこともあるので、反応条件には注意を払う必要があります。
アルドール縮合とクライゼン縮合の違いは何?
よく似た反応にアルドール反応・アルドール縮合があります。一体何が違うのでしょうか?
クライゼン縮合はエステルを使いますが、アルドール縮合はケトン・アルデヒドを用いる縮合です。エノール(エノラート)に対して反応するのはアルデヒドやケトンなのがアルドール反応です。反応後脱水すればα,β-不飽和カルボニルを生成します(アルドール縮合)。
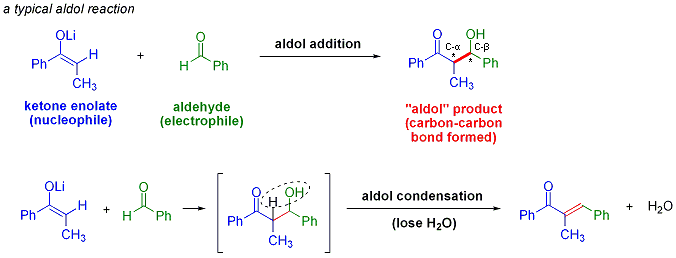
アルドール反応の概要 from wikipedia public domain
ディークマン縮合 (分子内クライゼン縮合)
ディークマン縮合は分子内のクライゼン縮合で同一分子内にエステルとエノール化可能なエステル(ケトン)が共存している分子で起こります。
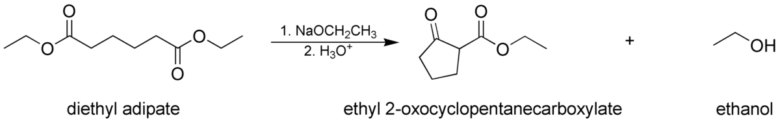
ディークマン縮合 from wikipedia by Jesse CC3.0
アジピン酸エステルの一方がエノール化し、もう一方のエステルに攻撃します。これによって環状ケトエステルが生成します。ディークマン縮合は分子内に3つ以上のエステルなどが存在する場合に、5員環または6員環どちらも形成可能なパターンがあります。これらは反応条件(温度や溶媒、塩基)によって選択性が変化します。
分子内環化であるため高希釈条件で反応を行うことによって分子間反応を低減させることができます。
環化周りの置換基によって生成物の環サイズの選択性が変化します。
シュトッベ縮合 (stobbe condensation)
シュトッベ縮合はジエステルを使った縮合反応です。コハク酸ジエステルとベンゾフェノンとの反応が良い例です。
コハク酸ジエステルのエノラート(省略して記載)がケトンに攻撃して、生成した酸素アニオンが分子内のもう一方のエステルを攻撃して分子内環化します。酸性度の高い水素が脱離して不飽和カルボン酸エステルが生成します。

V8rik at the English Wikipedia [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/)]
反応条件
クライゼン縮合では塩基としてナトリウムエトキシドやナトリウムメトキシドなどのアルコキシドの他、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム(NaH)、ナトリウム(Na)、ナトリウムアミド(NaNH2)、LDA(リチウムジイソプロピルアミド)などが使われます。水酸化物は求核性のある塩基であるため避けられることがあります。NaHやLDAなどは求核性が無い塩基であるため好まれます。
また、酸条件でも進行することが知られており、塩化アルミニウムやBF3・Et2O、塩化チタン(IV)などが使われます。
TiCl4/Bu3N,cat.TMSOTf でクライゼン縮合
ルイス酸のTlCl4が効率的になクライゼン縮合の試薬であるという報告があります。
溶媒はトルエンを使用し、室温で2~3時間反応させます。モル比は ester : TiCI4 : Bu3N :TMSOTf : (ester acceptor) = 1.0 : 3.0 : 4.5 : 0.05 : (3.0)で反応させます。交差クライゼン縮合の他、ディークマン縮合にも適応可能であることが示されています。
反応はシン選択的に進行するようです。
Yoshida, Yoshihiro, et al. “TiCl4/Bu3N/(catalytic TMSOTf): Efficient agent for direct aldol addition and Claisen condensation.” Tetrahedron letters 38.50 (1997): 8727-8730.