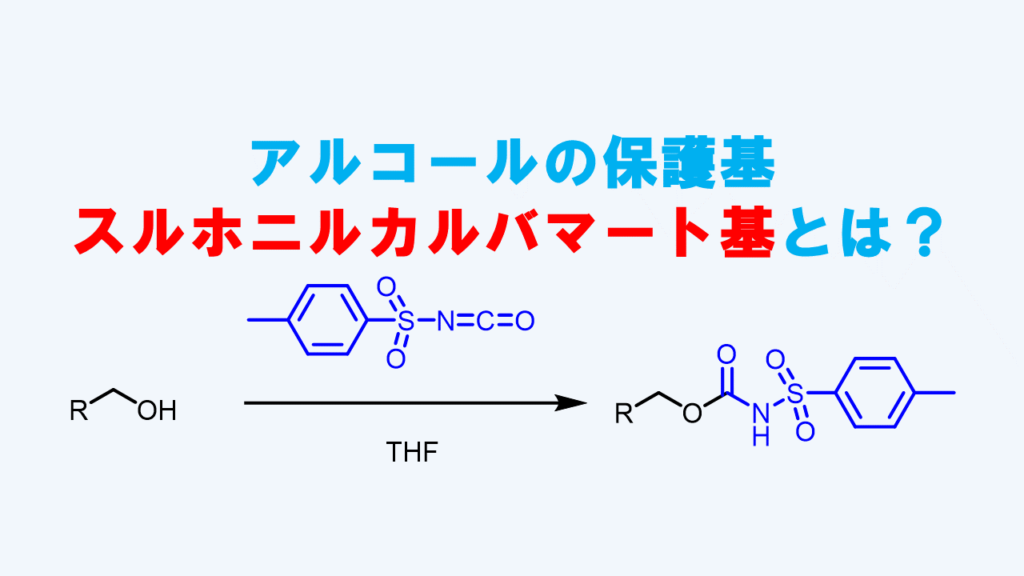
p-トルエンスルホニルカルバマート基とは
p-トルエンスルホニルカルバマート基は2013年真鍋らによって開発された保護基で、強塩基ではNHプロトンが脱プロトン化されるため安定な一方で、弱塩基条件下(ピリジン)では脱保護されるというユニークな特徴を持っています。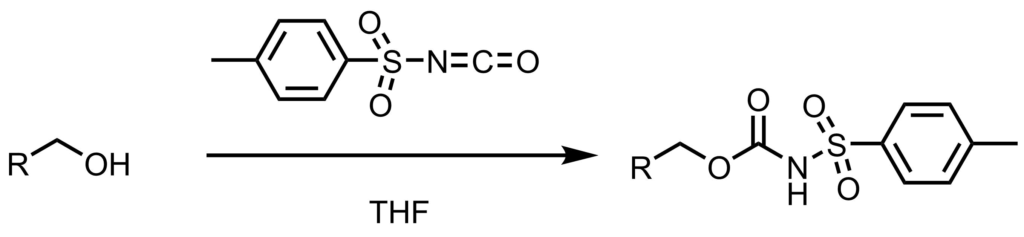
特徴・利点
p-トルエンスルホニルカルバマート基の利点や特徴は
- 強塩基下では安定だが、弱塩基性条件では脱保護される
- 保護反応は中性条件下進行し、反応速度も速い
- 第三級アルコールも保護可能
- 直交性が高い(TBDPS、Bn、Bzなど)
保護化試薬は試薬会社で販売されていて、安価です(TCI、25 g, \ 1,600)です。中性条件下ですばやく保護可能です。
反応機構
反応機構ー保護
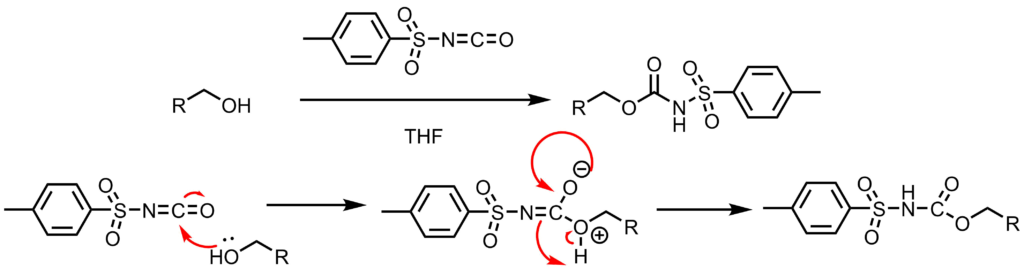
イソシアネートへアルコールが攻撃することによってスルホニルカルバマートが生成します。
反応機構ー脱保護
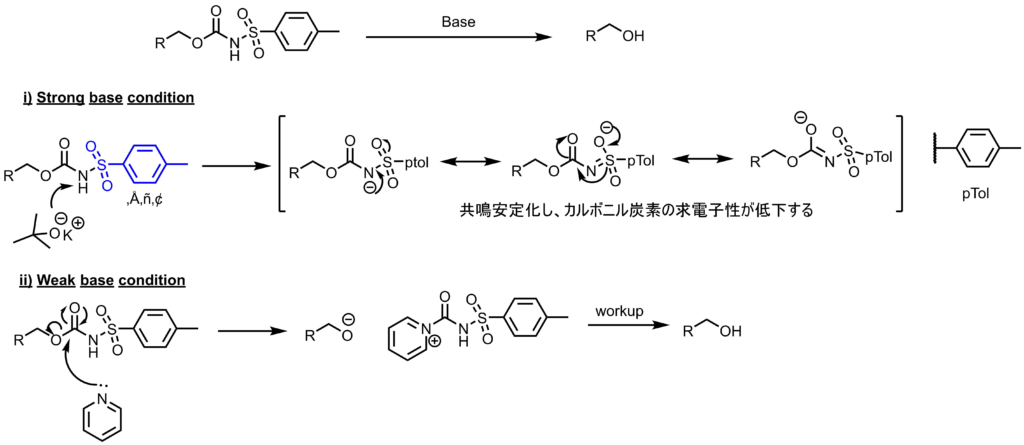 脱保護は塩基性条件下で行われますが、強塩基条件では、スルホンアミドのプロトンが奪われることによってカルバメートの求電子性が落ちるため反応が進行しません。弱塩基性条件では脱プロトン化が進行しないため、カルバメートの炭素に攻撃して脱保護されたアルコールが生成します。
脱保護は塩基性条件下で行われますが、強塩基条件では、スルホンアミドのプロトンが奪われることによってカルバメートの求電子性が落ちるため反応が進行しません。弱塩基性条件では脱プロトン化が進行しないため、カルバメートの炭素に攻撃して脱保護されたアルコールが生成します。
反応条件-保護
p-スルホニルカルバマート基はスルホニルイソシアネートとアルコールの反応により導入します。この反応は中性条件下で進行します。保護反応はアルケンやエポキシ、エステル存在下でもこれらの官能基に影響を与えずに進行します。
保護条件例1
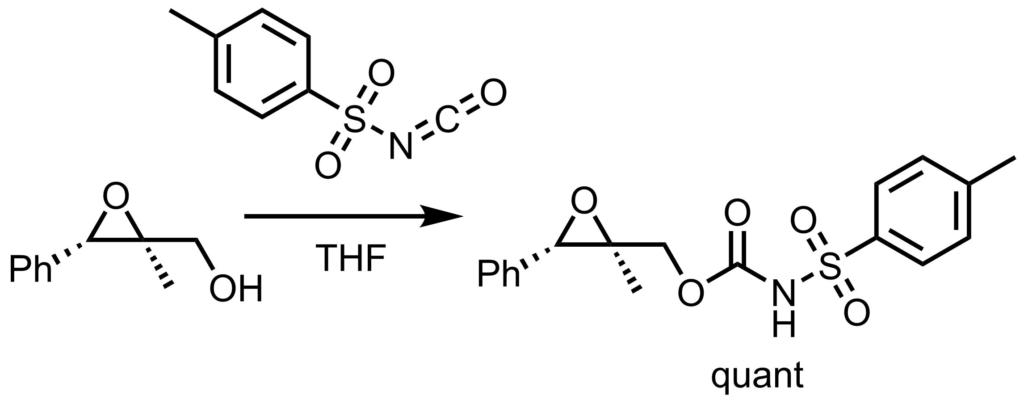 THF(5mL)にアルコール(1.0mmol)を溶解し、p−トルエンスルホニルイソシアネート(1.1mmol)を窒素雰囲気下、室温で加えた。反応後、濃縮、 残渣をシリカゲルカラムクロマトグラフィーで精製して生成物を得た(quant)。Shino, Manabe et al. ChemComm. 2013, 49, 8334.
THF(5mL)にアルコール(1.0mmol)を溶解し、p−トルエンスルホニルイソシアネート(1.1mmol)を窒素雰囲気下、室温で加えた。反応後、濃縮、 残渣をシリカゲルカラムクロマトグラフィーで精製して生成物を得た(quant)。Shino, Manabe et al. ChemComm. 2013, 49, 8334.
脱保護反応例
脱保護は弱塩基性条件で行います。報告されている脱保護方法には三種類あります。
- ICH2CN、K2CO3、MeCN、に続いて1M NaOH
- TMSジアゾメタン、MeOH/ベンゼンに続いて1M NaOH
- ピリジン/MeOH (7:3) 50℃
1ステップで簡便なピリジン/メタノールの方法がおすすめで、Fmoc基は脱保護されてしまいますが、多くの官能基に影響を与えずに脱保護できます。
反応例1
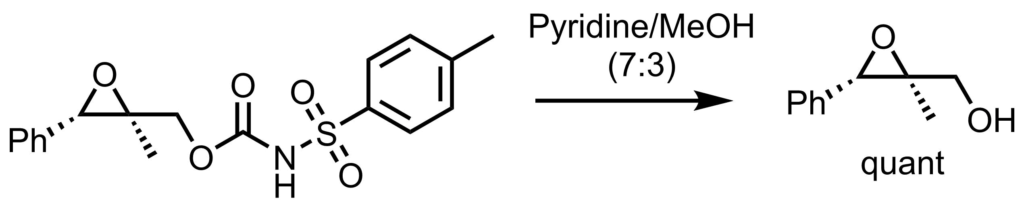 保護体(100mg)にピリジン:メタノール(5 mL, 7:3)に溶解し、50℃反応させた。原料消失後、そのまま濃縮し、残渣をシリカゲルカラムクロマトグラフィーで精製し、目的物を得た(quant)。
保護体(100mg)にピリジン:メタノール(5 mL, 7:3)に溶解し、50℃反応させた。原料消失後、そのまま濃縮し、残渣をシリカゲルカラムクロマトグラフィーで精製し、目的物を得た(quant)。
注意事項ーTips
- トシルアミドのNHプロトンは酸性度が高く、脱プロトン化するためアルキル化反応などでは副反応が起こる可能性があるので注意する。Nアルキル化するとスルホニルカルバマート基は塩基性に弱くなる。
- スルホニルカルバマート基が耐えられる条件は、四酸化オスミウム/NMO、アリルマグネシウムブロミド、デスマーチン酸化、ジョーンズ酸化、NaBH4、TFA/H2O(1:1)、NaOMe、HFaq、DDQ酸化です。
参考まとめ
Wuts, Peter G. M.. Greene’s Protective Groups in Organic Synthesis fifth edition (p.374). Wiley.
[blogcard url=”https://www.tcichemicals.com/ja/jp/product/tci-topics/ArticleHighlights_20140303.html”]