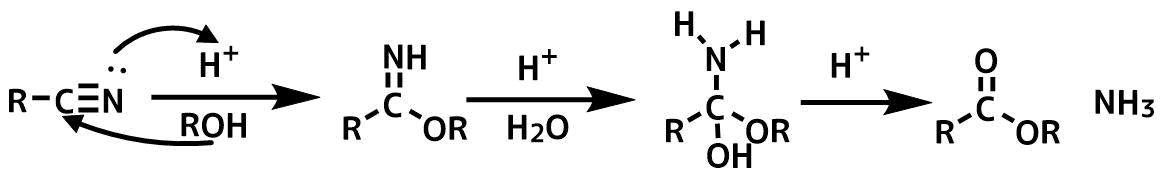
ニトリル(CN)は加水分解によってエステルに直接変換することが可能です。
カルボン酸誘導体であるニトリルは加水分解によってアミド、エステル、カルボン酸などに変換できます。
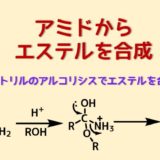
ピナー反応はニトリルをアルコール分解(アルコリシス)してイミノエーテルとした後、加水分解してエステルにを得る反応です。
ニトリルのアルコリシスでエステル合成
ニトリルは加水分解すればアミド、カルボン酸、還元すればアルデヒド、アミンなどに変換可能なカルボン酸誘導体です。
ニトリルのエステルへの変換は「ピナー反応」と呼ばれています。
ニトリルを酸触媒下、アルコリシスすることによってニトリルはイミノエーテルを経由して加水分解によりエステルに変換されます。
ニトリルをアルコリシスをする
具体的にはニトリルは、アルコール中で酸触媒(硫酸や塩酸、p-TSA、陽イオン交換樹脂等)とともに還流することによってエステル化できます。
メチルエステルを合成する場合、塩化水素-メタノールもおすすめです。こちらは1N HCl-MeOHなどとして試薬会社から購入することが可能な他、自前でメタノールとTMSClやAcClから調製できます。
ニトリルのアルコリシスは二段階です。
アルコリシスによって精製するイミド酸エステル(イミノエーテル・イミデート)の塩は「ピナー塩」と呼ばれています。
中間体のイミノエーテルを加水分解するために等モルの水を加える必要があります。
水を加えすぎるとカルボン酸まで加水分解するので注意です。
p-TSA一水和物を加えると等モルの水を加えることになるので便利です。
Ellis, James E., et al. “Development of a Scalable Process for CI-1020, A Novel Endothelin Antagonist1.” Organic Process Research & Development 5.3 (2001): 226-233.
ピナー塩はさらにアルコリシスするとオルトエステルになります。また、アミノリシスするとアミジンになります。
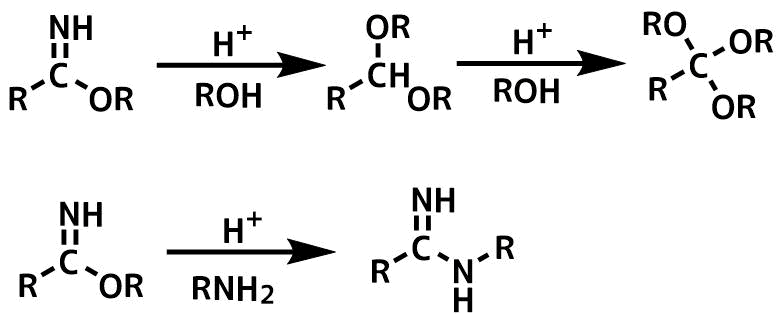
ピナー塩の反応 一段目はアルコールとの反応によりオルトエステル、二段目はアミンとの反応によりアミジンが生成している
反応条件
ピナー反応は多段階反応で目的のエステルが思うように得られないことも多いです。
酸触媒としては
- 硫酸
- 塩酸
- p-TSA
- 陽イオン交換樹脂等
等が使われます。強酸は基質が酸に弱い時には使いにくく、後処理で十分に分液ができないというときなどは陽イオン交換樹脂がおすすめです。基質が溶解しやすければ反応後ろ過するだけで除去できます。
アルコールは溶媒量用いて問題ありません。反応が進行しにくい場合は還流することも多いです。
ニトリル体は溶解性が低いことも多い?ので溶媒量で加熱溶解させて反応させることもあります。
4NHCl-CPMEの利用
HCl-メタノールを使ったニトリルのアルコリシスはよく利用されていますが、近年HCl-CPMEが有用であるという報告があります。
主な利点は
- HCl-CPMEが4当量だけで良い
- CPMEを溶媒とすることでが生成したエステルが沈殿する場合がある(MeOH溶媒よりも溶解性が低いから?)
- HCl-ジオキサンと比べて飛ばしやすく、酸にも安定
ということです。反応は簡単で0℃下でHCl-CPME(4eq)と無水アルコール(3eq)とCPME(溶媒量)を混合させるだけです。基質にもよると思いますが、反応後冷却すると生成物が沈殿するようです。
沈殿しなくてもMeOHやジオキサンの場合は分液するのに濃縮操作が必要ですが、CPMEではそのまま分液できるメリットもあります。
Watanabe, Kiyoshi, et al. “Improved Pinner reaction with CPME as a solvent.” Synthetic Communications® 39.11 (2009): 2008-2013.
ルイス酸(TMSOTf)を使った方法
塩化水素はよく使われる酸ですが、取り扱い性が悪いのが難点です。
ルイス酸のうちハフニウムトリフラートは取り扱いが容易でかつピナー反応に有効であると報告されています。もっと安価なルイス酸を探索した結果PtaffらはTMSOTfが有用なであることを発見しました。
芳香族ニトリルの反応は収率が低く、フェノールのエステルは合成できません。
アルコール(1当量)、TMSOTf(2当量)をニトリルに溶解(4 mL / mmolアルコール)、室温、65時間で反応させています。
Pfaff, Dominik, Gregor Nemecek, and Joachim Podlech. “A Lewis acid-promoted Pinner reaction.” Beilstein journal of organic chemistry 9.1 (2013): 1572-1577.
エステル体が得られない時
ニトリルから思うようにエステルが得られない時もあります。
多段階で進行する反応あるいは、中間体で停止する反応は反応条件の調節が難しいです。
対処法をいろいろ挙げてみます。
- カルボン酸になってしまう場合は基質や溶媒、試薬に水が混入していないか?
- 複雑な混合物になる場合は酸に不安定ではないか?熱かけすぎか?中間体で止まっていないか?を確認して条件を変更する
- 中間体が結構得られるなら中間体を回収してからもう一回反応をかける(多段階にする)
- ニトリルからアミドを作ってからエステルにする反応に切り替える
- ニトリルからカルボン酸まで完全に加水分解してからエステル化する
基質が安定なら4や5の選択もありです。特にエステル化は信頼性が高い反応でもあります。
いったんアミドにしてからという方法もありです。

ニトリルのエステルへの変換を行いたいのですが、「p-TSA一水和物を加えると等モルの水を加えることになるので便利」というのはどのような当量などで加えればいいのでしょうか?いい論文などがあれば教えていただきたいです。
記事をお読みいただきありがとうございます。
p-TSA・H2Oの量は基質のニトリルの1~2当量加えればOKです。
基質1molに対して、p-トルエンスルホン酸・一水和物を(1mol)加えると1molの水を加えたのと同じになります。実際の合成ではp-TSA・H2Oを基質の1~2eq加えるようです。
1番目の論文では分子内ピナー反応で、2当量のp-TSA・H2Oを加えています。
2番目の論文はプロセス化学の論文で、小スケールの時にp-TSA・H2O試していて高収率で得ています。、残念ながら詳しい条件は書いてありませんが、1~2当量のp-TSAを加えて反応させているはずです。
お役に立てれば幸いです。
Ahn, Sang‐Hyun, Hee Nam Lim, and Kee‐Jung Lee. “Application of the acetate of baylis‐hillman adducts of salicylaldehydes in the synthesis of methyl 2‐oxo‐2, 3‐dihydrobenzo [b] oxepine‐4‐carboxylates.” Journal of Heterocyclic Chemistry 45.6 (2008): 1701-1706.
Ellis, James E., et al. “Development of a Scalable Process for CI-1020, A Novel Endothelin Antagonist1.” Organic Process Research & Development 5.3 (2001): 226-233.
こんにちは。私もピナー反応を行ってメチルエステル体を作りたいと思っています。上に上げてくださった論文は分子内反応ですが、分子間反応で行う場合、MeOHはどのくらいの量加えれば良いでしょうか。溶媒にしてしまっても良いのでしょうか?
ご覧いただきありがとうございます。
溶媒量用いて問題ないですよ