脱離基とは?
脱離基は簡単に言えば「電子を奪って結合が切るひとかたまり(原子団)」のことです。
電子を奪う側が脱離基なので脱離基には電気陰性度の高い陰性原子が多く含まれています。アニオンが生じる場合はアニオンが安定して存在しやすい構造をもっています。
全ての脱離基がアニオン性かというとそうではありません。例えば強酸性条件ではアルコールは中性の脱離基として機能します。
脱離能について
脱離能とは脱離のしやすさのことです。
アニオンとして安定して存在できる構造を持っているものはそうでないものと比べて、脱離しやすいはずです。
ではどうすれば脱離能が高い構造、脱離のしやすさを予測できるでしょうか?
これは酸性の強さを考えると想像しやすいです。
H-Xという分子で酸性度を考える
脱離基Xに対して結合してるものが水素Hと考えてみましょう。
H-Xという分子ではXがHと比べて電気的に陰性で水素Hから電子を奪いやすい構造とします。
では実際にXを脱離させてみましょう。
H-X → H+ + X–
Xが脱離してXアニオンが生じると、H+というカチオンが生じます。
H+はいわゆる酸ですよね?
H-Xの 「Xが外れやすいほど」→ 「H+が生じやすい」ということになります。
これは逆に言えば「H+が生じやすいほど」→「Xがはずれやすい」と言い換えられます。
Xの脱離能が高いHXほど、H+がたくさんできる。。つまりHXが強酸性であるほどXは脱離能が高いと言えます。
脱離能を比較して脱離能の順番を考える
具体例をみてみましょう。
下記のプロトン(H+)を生じる構造を持つ分子のうち脱離能が最も高い脱離基を持つのはどれでしょうか?
- 塩酸 (H-Cl)
- 酢酸 ( H-OCOCH3)
- メタノール(H-OCH3)
- メタン(H-CH3)
Hの片割れの構造が脱離基として考えてください。
ここで最も酸性度が高いのは塩酸なので最も脱離能が高い脱離基を持つものは塩酸になります。
最も高い脱離能を持つものは酸性が高いもの(X-として生じやすいもの)です。
脱離能の順番も酸性度が高い順にならんでいるので
- 塩化物イオン (-Cl)
- カルボキシレートアニオン (-OCOCH3)
- メトキシド(中性脱離基メタノールとして脱離)(-OCH3)
- メタン(H-CH3)
となります。
酸性度がだいたいわかれば脱離能の高さが見積もれます
I-とCl-は脱離能が高いのはどちらでしょうか?
これはヨウ化物イオンの方です。ヨウ化水素と塩化水素ではヨウ化水素のほうが強酸です。
トリフルオロメタンスルホン酸は非常に強い酸であり、これはトリフラート基と呼ばれる非常に脱離能の高い脱離基として有名です。
脱離基の意義
「分子の一部の構造を別の構造に変えたい」という場合に脱離基は役立ちます。
切りたい部分の結合が簡単に切れればよいのですが、そう簡単にいきません。場所によって切れやすい結合と切れにくい結合があります。
例えばアルコールをハロゲン化アルキルに変えたい場合
R-OH → R-Cl
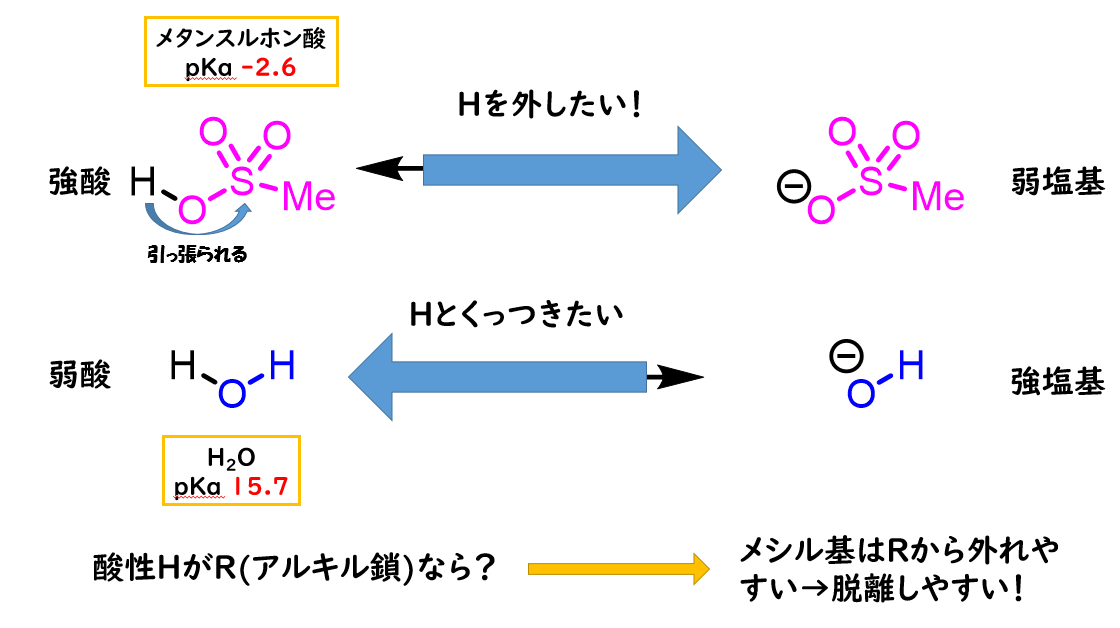
-OHは酸素の電気陰性度が高く脱離基として優秀そうな気がしますが、酸性度を基に脱離能を考えてみると優秀ではないことがわかります。
H-OH(水)として考えると水は中性で酸性度は高くないですよね?
つまり脱離基-OHは安定して存在できないために脱離能は高くありません。したがって、アルコールのR-OHを切断するのは大変です。
そこで、アルコールのOHを脱離しやすい構造に変換する→OHをより優秀な脱離基に変えてあげます。
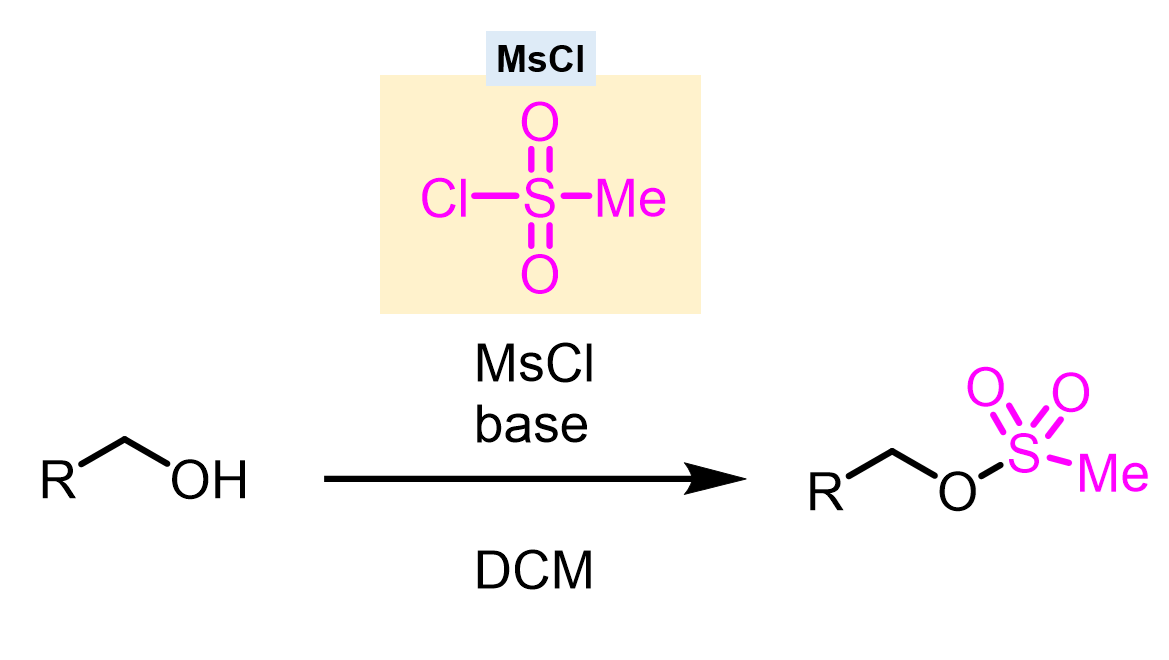
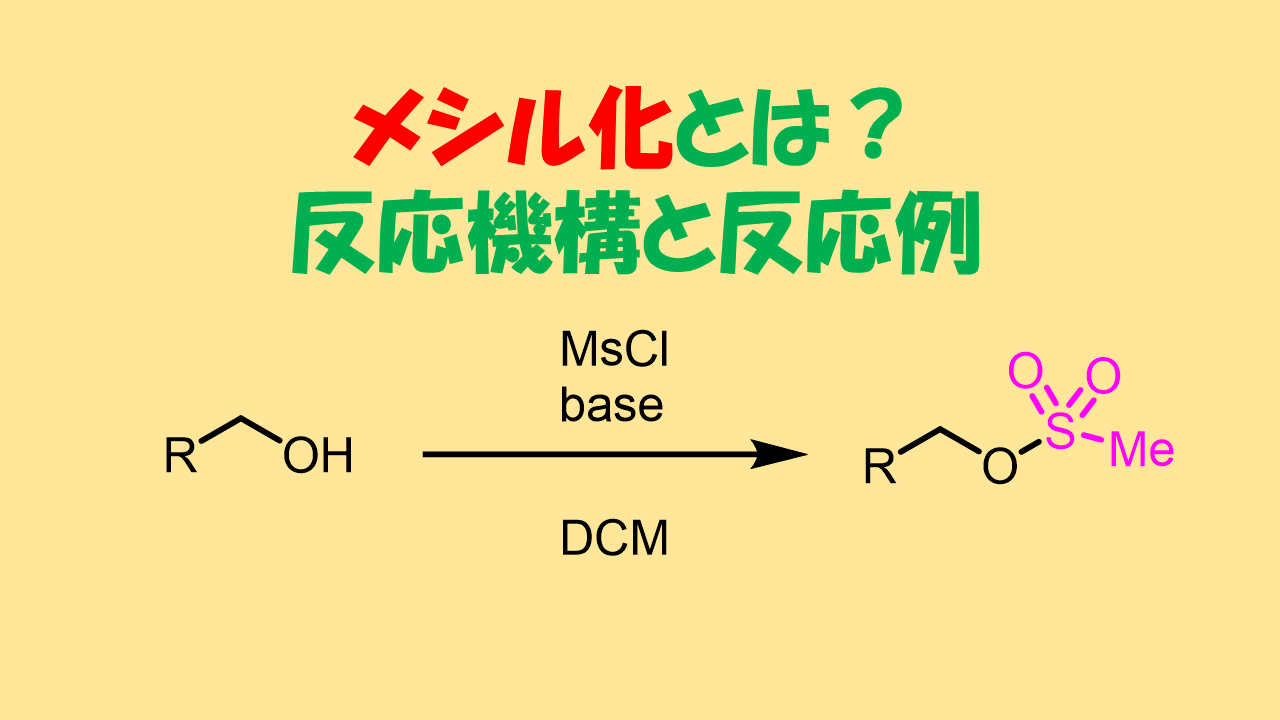
代表的な脱離基はメシル基やトシル基というものがあります。メシル基はメタンスルホン酸、トシル基p-トルエンスルホン酸という強酸に含まれる部分構造です。

結合開裂には2種類ある
結合の開裂には
- ヘテロリシス
- ホモリシス
の2種類あります。
ヘテロリシスでは結合に使われている電子2つが一方の原子団に移動して開裂がおこります。
ホモリシスでは開裂する原子団に電子が1つずつ分配されます。