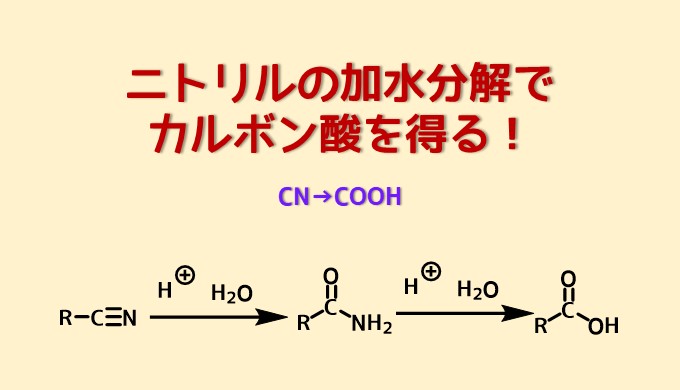
ニトリルを加水分解するとアミドを経由してカルボン酸に変換されます。
ニトリルの加水分解は酸または塩基で行います。
本記事ではニトリルからカルボン酸を得る方法について紹介します。
ニトリルの加水分解
ニトリルの加水分解は酸あるいは塩基条件で進行します。
ニトリル→アミド→カルボン酸という経路で進行します。
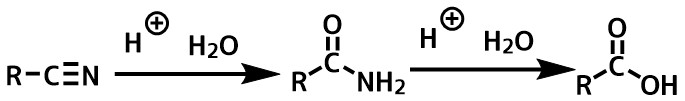
ニトリルの加水分解
そのため途中で反応を停止できればアミドが得られます。
ニトリルは求核置換により簡単に導入できるため、カルボン酸等価体として重要です。
加水分解の条件
ニトリルの加水分解はアミドやエステルの条件と同じような条件を使えます。
酸性条件では塩酸や硫酸、あるいは酢酸、ギ酸などのカルボン酸も利用できます。
塩基性条件では、NaOH、KOH、水酸化バリウムなどが使われます。アミドと同様にアルコール溶液で加水分解できます。
ニトリルの加水分解の難点はアミドで加水分解が停止してしまうことがあることです。
主に酸性条件を使うとアミドで停止することが多いようで、酸性で加水分解してアミドとして、それを塩基性で加水分解してカルボン酸とするという二段階加水分解が行われることも多いです。
酸性条件でのニトリルの加水分解
HCl+KOHの二段階加水分解

Hawes, Chris S. et al Crystal Growth & Design, 14(11), 5749-5760; 2014
アミド(450 mg、1.4 mmol)を10 mLの37%塩酸溶液に溶解し、空気中で48時間加熱還流した。
冷却したら、白色固体をろ過、水で洗浄し、得られた固体に20mLの2M KOH溶液に加え、24時間還流した。
得られた淡黄色の溶液を水で50 mLに希釈し、3 mLの氷酢酸を加えて2時間放置した後、生成物を濾過により単離、水で洗浄し、真空で乾燥させて目的物を44%で得た。
酸性によりアミドとした後に塩基で加水分解する二段階の方法です。
塩基性条件でのニトリルの加水分解
ニトリルのNaOHの加水分解
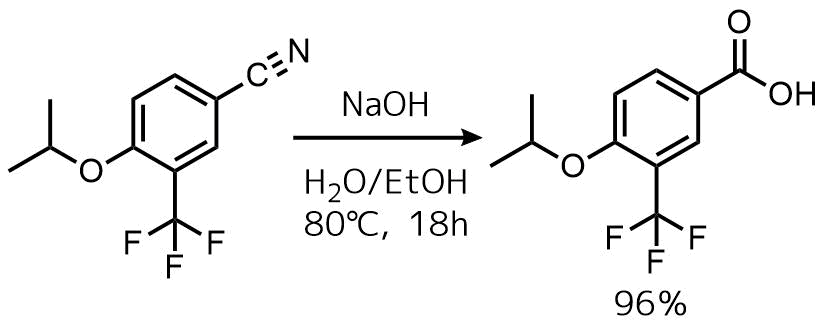
Buzard, Daniel J. et al ACS Medicinal Chemistry Letters, 5(12), 1334-1339; 2014
ニトリル(183 g、798 mmol)のEtOH(1 L)溶液に5N NaOH(559 mL、2.80 mol)を加えて混合物を80℃で18時間加熱した。濃縮後、1NHClで酸性にし、生じた沈殿をろ過、固体を水およびヘキサンで洗浄した。固体をEtOAcに溶解し、MgSO4で乾燥させた。濃縮して目的物を96%の収率で得た。
過酸化水素で酸化によりアミドとした後カルボン酸に変換

Bavetsias, V. et al Journal of Medicinal Chemistry, 45(17), 3692-3702; 2002
ニトリル(4.0 g、0.024 mol)、30%KOH水溶液(56 mL)、および30%H2O2(4 mL)の混合物を、130°で2時間撹拌した。反応後室温まで冷却し、水(200 mL)で希釈し、3 N HClでpH 5.5に酸性化し、室温で数時間放置した。生じた固体をろ過して目的物を93%で得た。
ニトリルを塩基性条件下で過酸化水素を作用させると酸化的にアミド化されます。アミドをさらに加水分解するとカルボン酸が得られます。
アセトニトリルの酸加水分解の反応機構
ニトリルの加水分解はニトリルがプロトン化されることから始まります。
- ニトリルのプロトン化により求電子性が上がったニトリルの炭素に水が攻撃する
- 酸素からの電子押し出しによりイミンC=Nがプロトン化される
- アミドの生成
- アミドがプロトン化により求電子性が上がったアミドの炭素に水が攻撃する
- 酸素の脱プロトン化
- アミンがプロトン化
- 酸素からの電子の押出によりアミンが脱離する
- 酸素の脱プロトン化
- カルボン酸の生成
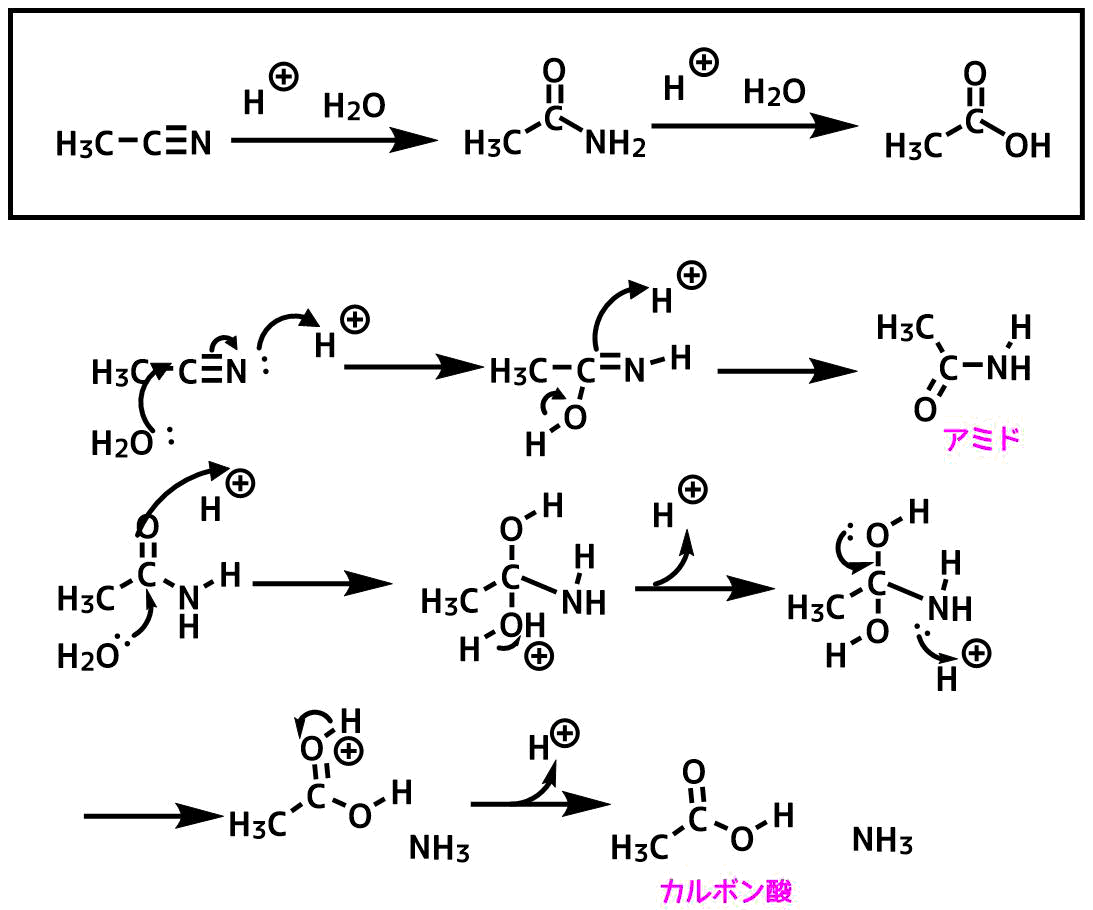
アセトニトリルの加水分解反応機構
ベンゾニトリルの塩基性条件下でのニトリルの加水分解反応機構
ニトリルは塩基性条件でも加水分解されます。
ベンゾニトリルの例を示します。
- 水酸化物イオンがニトリルの電子不足な炭素に攻撃する
- プロトン化
- 水酸基の脱プロトン化からのイミンのプロトン化
- 生成したアミドに水酸化物イオンが攻撃
- アニオンの押出しからアミドイオンが生成
- アミドイオンがカルボン酸のプロトンを奪う
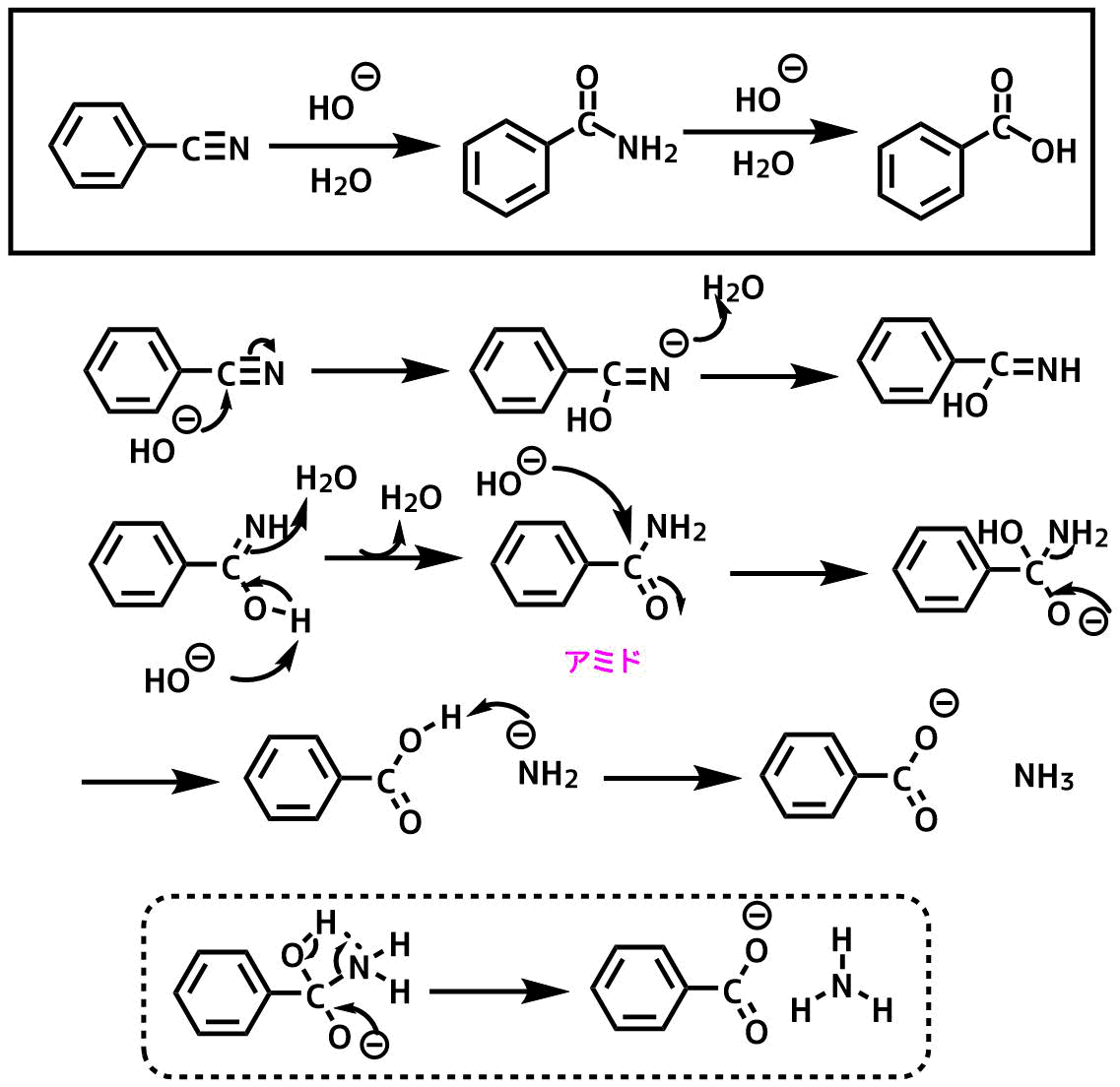
ベンゾニトリルの塩基加水分解反応機構
反応の律速
ニトリルの加水分解は下記の段階をたどります。
ニトリル – > アミド -> カルボン酸
脂肪族ニトリルからカルボン酸を得る反応の律速段階は酸条件・アルカリ条件ともにニトリルからアミドが生成するまでの段階です。
一方
芳香族ニトリルの場合はアルカリ条件においてはアミドからカルボン酸を生じる段階が律速になります。別の言い方をすればアミドからカルボン酸への加水分解はアルカリ条件では進行しにくいともいえそうです。
小方芳郎, and 岡野正彌. “芳香族ニトリルのアルカリ加水分解速度に就て.” 日本化學雜誌 70.1-2 (1949): 32-34.