前回は結合についてでしたが、今回はイオンについてです。
イオンといえば、「マイナスイオン」が有名ですね。
「滝の近くはマイナスイオンがたくさん出ていて健康に良い」といわれていたり、なんか健康に良いものだと感じているひとが多いのではないしょうか?
「マイナス」があれば、「プラス」もありそうですよね?
実はあまり聞きなじみがないと思いますが「プラスイオン」もあります。(プラスイオンとはあまり言いません。カチオンといいます)
このイオンの正体は何か? じつは、それは「原子」です!
原子とイオンの関係
原子はもともと+とーの粒子が同じ数だけ集まってできたプラスマイナスゼロの状態です。
例えば水素はプラスの粒子1つとマイナスの粒子1つでプラスマイナスゼロになっています。
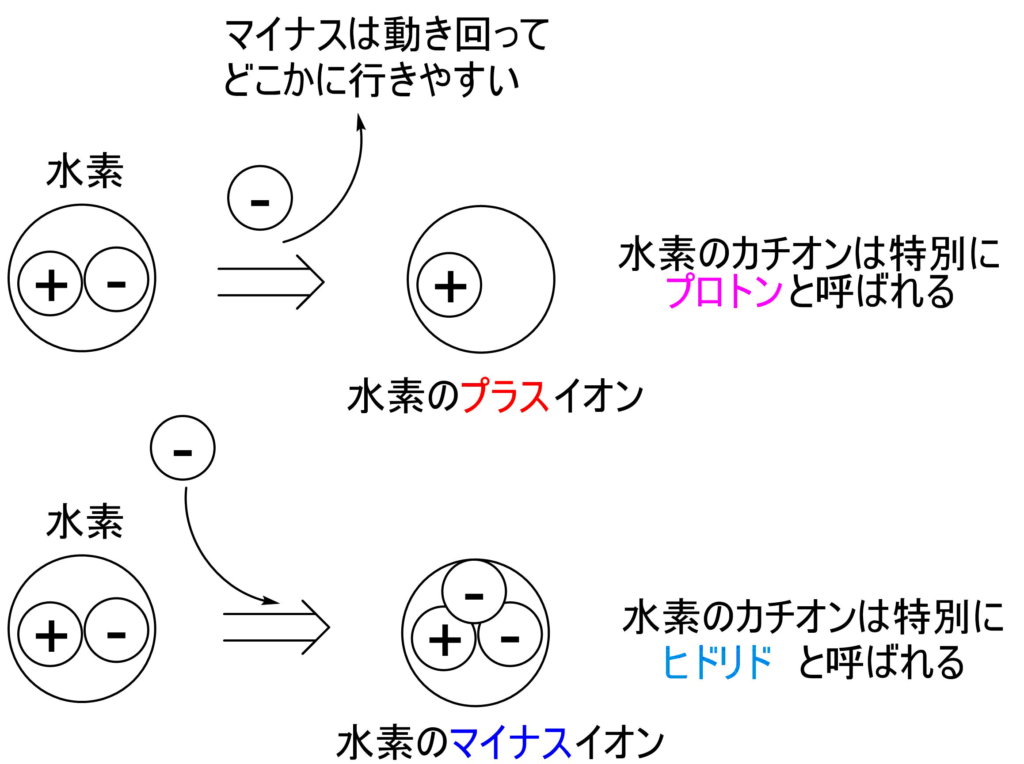
水素原子をつくっているマイナスの粒子は常に動き回っていて、どこか別の場所に行きやすい性質があります。
水素から離れていくと、水素はプラス1の状態になるのでプラスイオンになります。
一方で、水素にマイナスの粒子がくっつけば、マイナス1の状態になるのでマイナスイオンになります。
実はこのマイナスの粒子の正体は「電子」です。電子はマイナスの粒子なのです。
イオンはくっつく?
イオンはもとの原子(プラスマイナスゼロ)の状態とは違ってプラスやマイナスの電気を帯びています。
このプラスやマイナスは互いに引き合ってくっつくことによってプラスマイナスゼロの状態になろうとします。
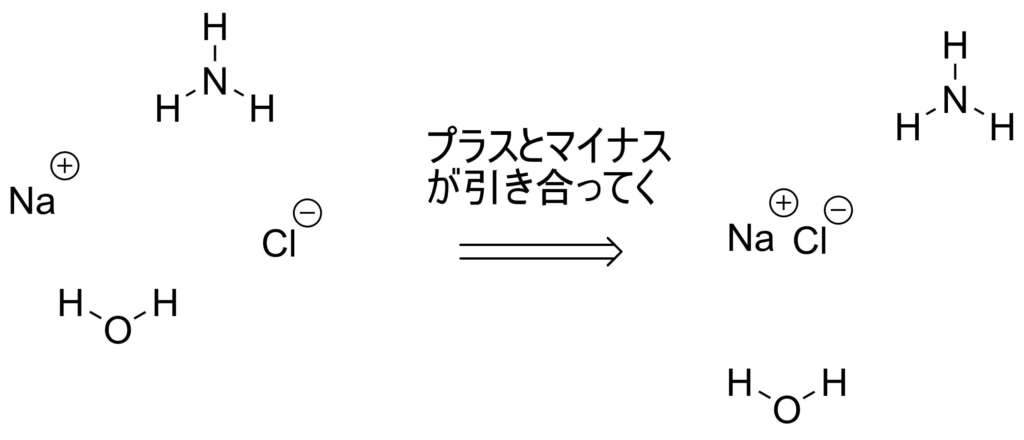 たくさん他の分子がある中で、NaのプラスイオンとClのマイナスイオンは互いに正反対の電気を帯びているので引き合ってくっつきます。こうなるとプラスマイナス0になって落ち着きます。
たくさん他の分子がある中で、NaのプラスイオンとClのマイナスイオンは互いに正反対の電気を帯びているので引き合ってくっつきます。こうなるとプラスマイナス0になって落ち着きます。
でもこれって、Clが持ってる余分なマイナスの電子をNa+に移動させてもプラスマイナスゼロになるはず?
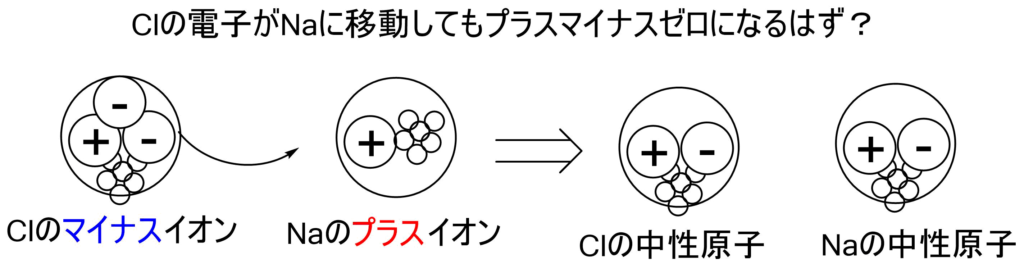
ですが、このようなことは起こりにくくなってます。
なぜかというと、Naはプラスになりたがっていて、Clはマイナスになりたがっているからです。
ですから、Naはプラスのまま、Clはマイナスのままでくっついてプラスマイナスゼロになったほうが、お互いの要求に答えられるのです。
NaやClに限らず、他の元素もマイナスになりやすいものとプラスになりやすいものがあります。
金属はプラスになりやすいです。
イオンのなりやすさって?
いちいちどの元素がどのイオンになりやすいかを覚えるのは面倒ですよね?
これを簡単に見分けられる方法があります。
周期表という表を利用する方法です。
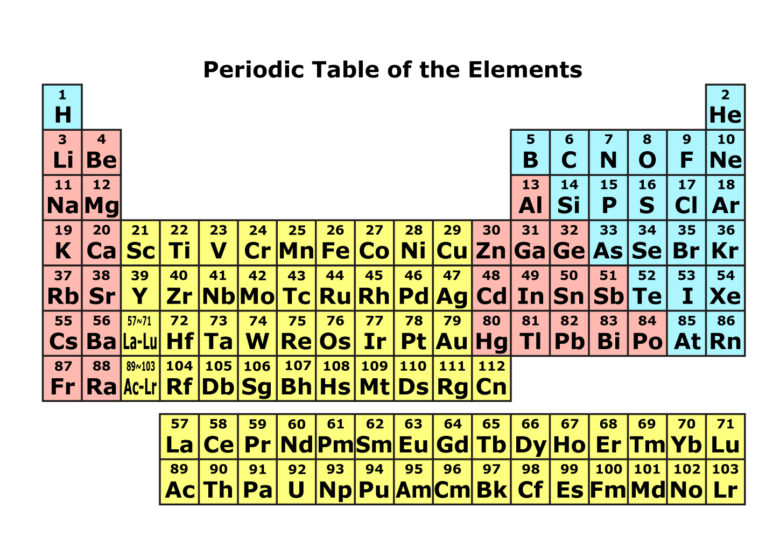
とっても簡単です。
周期表の左側にあるものはプラスイオンなりやすいです。
周期表の右側にあるものはマイナスイオンになりやすいです。
真ん中あたりにあるものはどっちでもないことが多いです。真ん中あたりの黄色と赤はシカトしましょう。
ちなみに最もマイナスになりやすいのはF(フッ素)です。FONCl(フォンクル)の順番です。語呂合わせ「フォンクル」とかで覚えてみましょう。(電気陰性度といいます)
反対にプラスになりやすい順番は「金属のイオン化傾向」とか言ってLi k Ca Na—「リー貸そうかなー」という語呂合わせで覚えた記憶があるかもしれません。
プラスのなりやすさはとりあえずそんなに気にしなくても良いです。
「第一イオン化エネルギー」という原子から一個の電子を取り去るのに必要なエネルギー(これが小さいほどプラスイオンになりやすい)を調べるとなりやすさがわかります。



