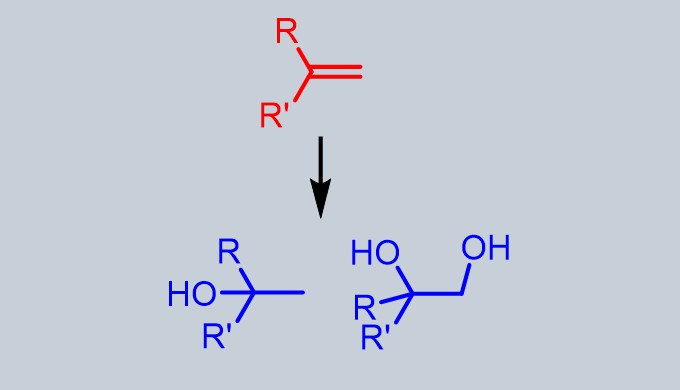
アルケンに対して付加反応によりアルコール、ジオールを合成することが可能です。
アルコールの合成としてはヒドロホウ素化が有名ですが、自動酸化やヒドロシリル化なども使えます。マルコフニコフ則か逆マルコフニコフ則などの選択性が反応条件の選定に重要になってきます。
ジオール合成の代表的な試薬は酸化オスミウムですが、毒性や価格などの問題から再酸化剤を用いて触媒量にげんじたり、ルテニウムなどの代替試薬を使うことも多くなっています。
アルケンからアルコールの合成法
最も教科書的で直接的な変換方法としては、酸触媒下、水を付加させる方法ですが、生じたカルボカチオンに対してアルケンが攻撃して重合や転位する副反応が起こることからヒドロホウ素化などの方法を取られることが多いです。
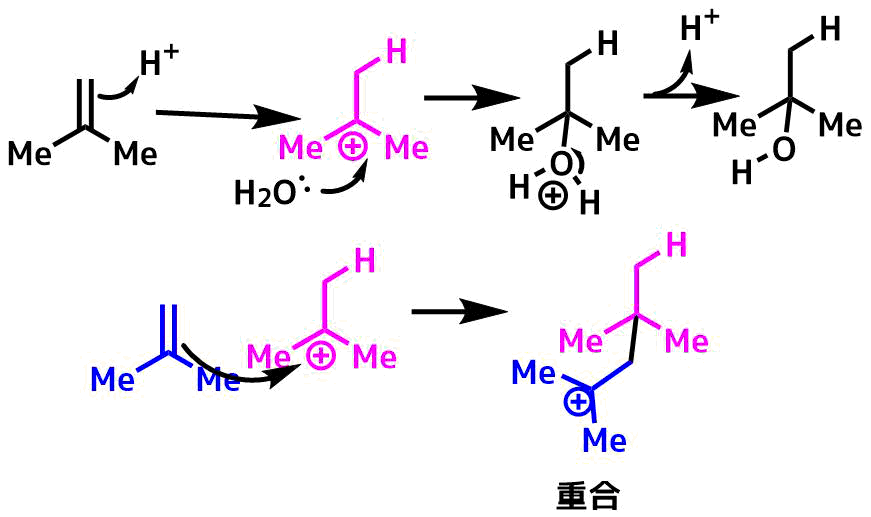
アルケンの水和は生じたカチオンに対してアルケンが反応する副反応(付加重合)が起きるために使いにくい(ポリエチレンやポリプロピレンはアルケンのポリマーです)。転位も起こりやすい。
アルケンへのヒドロキシ基の導入は酸化か付加反応によって行います。
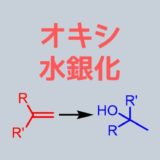
- オキシ水銀化
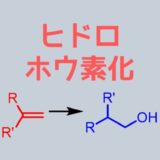
- ヒドロホウ素化
- ヒドロシリル化
- 自動酸化
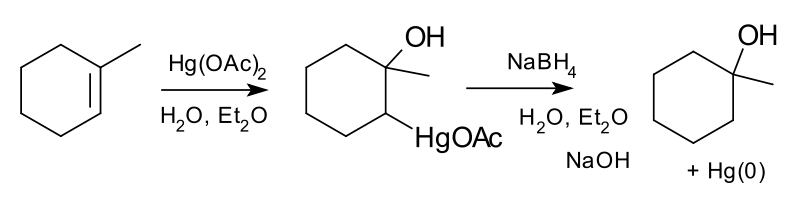
オキシ水銀化はメタノールでエーテル、水でアルコール
オキシ水銀化はHg(OAc)2・酢酸水銀(II)を用いたアルケンのヒドロキシ化です。
V8rik at English Wikipedia [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)]
立体の制御もしやすく嵩高い基を避けるようにしてヒドロキシ化が進行します。
ヒドロホウ素化ー酸化
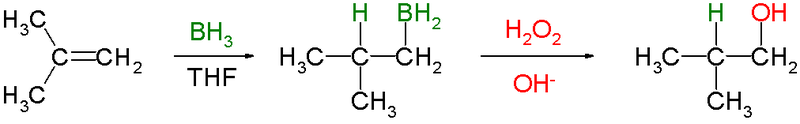
ヒドロホウ素化はH.Cブラウンによって開発された反応で、この功績により彼はノーベル化学賞を1979年に受賞しています。
アルケンをヒドロホウ素化すること自体はアルキルボランを合成する方法であり、これに対して酸化処理するとアルコールができます。酸化処理は過酸化水素とNaOHなどの塩基条件下で行います。
Enwiki [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/)]
ヒドロシリル化
ヒドロシリル化はアルケン・アルキンに対して金属触媒下アルキルシランを付加させて有機ケイ素化合物を得る反応です。ヒドロホウ素化と同じく酸化的に処理してアルコールを得ることができます。逆マルコフニコフ則に従ったアルコールを得ることができます。
アルコール合成法としてはヒドロホウ素化を使うほうが良いかな?と思います。
オレフィンの酸化
コバルト触媒(Co(acac)2)を使った自動酸化はマルコフニコフ則に従ったアルコールを合成できます。
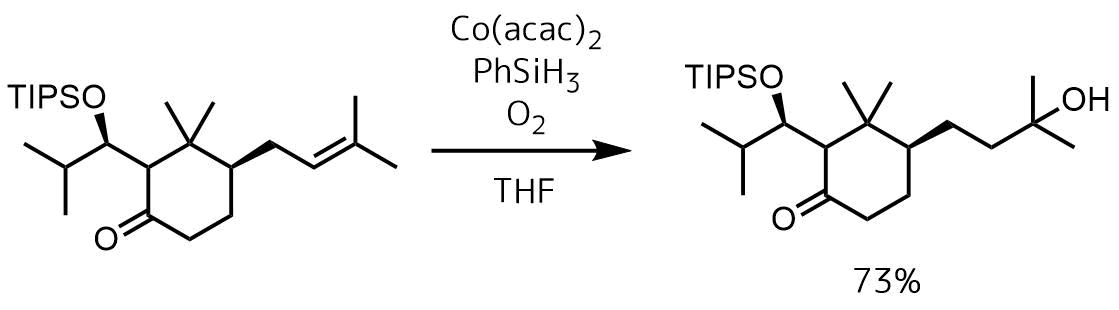
Kuramochi, Akiyoshi et al Journal of the American Chemical Society, 127(41), 14200-14201; 2005
ジオールの合成
オレフィンからのジオールの合成はアンチとシン体がある。両者の作り分けが合成上重要になってきます。
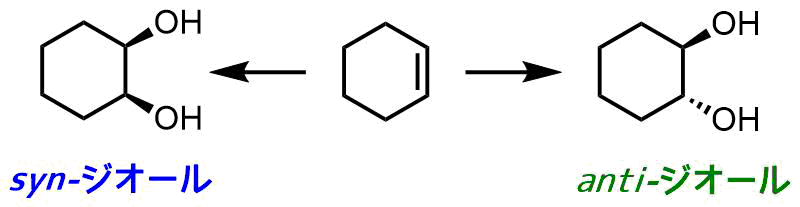
antiとsynジオールの合成
アンチ-ジオール
アンチチオールは有機過酸を使った酸化法が有用です。過酸化水素ー酢酸やギ酸がよく使われます。過酢酸を直接使うこともできますが、爆発性など取り扱いに難有りなため通常は過酸化水素からin situで過酢酸を調製して利用します。
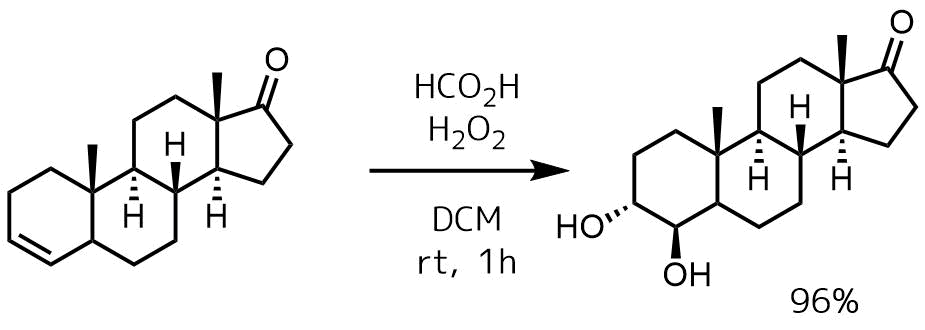
Cepa, Margarida M. D. S. et al Journal of Medicinal Chemistry, 48(20), 6379-6385; 2005
30%過酸化水素(0.05 mL、0.5 mmol)に90%ギ酸(0.05 mL、1.18mmol)を加えて室温付近に保った状態でオレフィン体(67.5 mg、0.25 mmol)のジクロロメタン溶液を滴下して加える。室温で1時間攪拌後、NaOH水溶液を加えて中和、抽出を行い目的物を96%で得た。
酸としては一般的にはギ酸、次いで酢酸が良く使われます。生じたアルコールがアシル化する可能性があります。ギ酸以外の酸を用いることもできます。
シン-ジオール
シン-ジオールの合成方法として有名なのが、四酸化オスミウムによる酸化です。しかし、四酸化オスミウムは有毒で高価という欠点があります。
代替のシン-ジオールの合成方法としては、
- 再酸化剤を加えて四酸化オスミウムを触媒量に減らす
- 塩基性過マンガン酸カリウム
- 三塩化ルテニウム
などがあります。
四酸化オスミウムによるシン-ジオールの合成
四酸化オスミウムは温和で選択的であり、アルケンからジオールを合成する方法として信頼性の高いものとして全合成でも良く利用されています。
アルケンにオスミウムが付加してオスミル化した後にジオールを与えます。
四酸化オスミウムの機構
四酸化オスミウムは求電子的であるため、電子不足なアルケンとは反応を起こしにくいです。電子豊富で、立体障害が小さいオレフィンが優先的に酸化されます。ピリジンを加えると反応が促進されます。
有用な四酸化オスミウムですが、有毒かつ高価であるため、使用料を触媒量に減ずるため、NMO、t-BuOOH、フェリシアンカリウム等を再酸化剤として加える方法が有用です。NMOのほうがペルオキシド系よりも副反応などが少ないので比較的よく用いられると思います。
現在では触媒的に利用する方法が主流かと思います。
溶媒は良く使う順にt-BuOH、アセトン、THFと水との混合溶媒を使います。
過マンガン酸カリウムは逆に電子不足なアルケンと反応しやすい
スタンダードなジオール化

Sulake, Rohidas S. et al Journal of Organic Chemistry, 79(22), 10820-10828; 2014
オレフィン(0.99g、4.98mmol)のアセトン/ H2O(33mL、10:1)溶液にOsO4 (0.12 g, 0.49 mmol) およびNMO(0.58 g、5.00 mmol)を室温で加えて24時間攪拌した。反応後10%Na2S2O3・5H2Oでクエンチし、30分間撹拌した後、EtOAc(3×10 mL)で抽出後、精製処理を行い目的物を95%で得た。
NMOを使う標準的な反応例です。オスミウムの量は10mol%と結構多くいれていますが1~5mol%くらいでもOKです。
エポキシやエステル、アルコール、アルキルハライド、アミンなどがあっても選択的にアルケンのジオール化が進行します。
過マンガン酸カリウムを用いたジオールの合成
塩基性過マンガン酸カリウムで酸化してもシンジオールが合成できます(酸性条件ではケトール、無水酢酸ではジオンになる)。
電子不足なオレフィンと反応しやすいのが特徴です。
欠点は過マンガン酸カリウムが強力な酸化剤のため、官能基選択性が低いところです。酸化を受けない単純な化合物(カルボン酸、アルカン)であれば安価で毒性も少なく大スケールでもOKです。
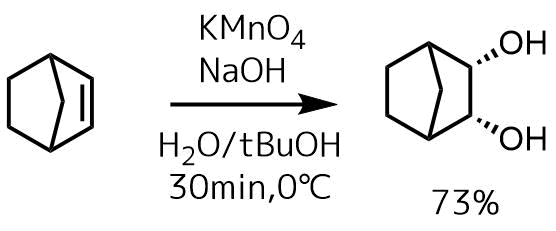
Donohoe, Timothy J. et al Chemical Communications, 47(20), 5849-5851; 2011
過マンガン酸カリウム(12.0 g、76.0 mmol)、水酸化ナトリウム(2.61 g、65.3 mmol)水(250 mL)溶液をオレフィン(5.00 g、53.1 mmol)の t-BuOH(200 mL)/水(50 mL)に0°Cで滴下して加えます。添加後30分撹拌し、反応後チオ硫酸ナトリウム水溶液でクエンチして抽出、精製処理を行い目的物を73%で得た。
末端アルケンの場合は酸化が進んで末端カルボン酸になるため注意します。
塩基を加えずに、硫酸マグネシウム(1eq)を用いてsynジオールを合成する方法もあります。
塩化ルテニウムによるジオール合成
過ヨウ素酸ナトリウムと塩化ルテニウムを用いた酸化ではsynジオールが合成できます。

Stambasky, Jan et al Journal of Organic Chemistry, 76(19), 7781-7803; 2011
オレフィン(337 mg、1.16 mmol)を酢酸エチル(5 mL)とアセトニトリル(5 mL)の混合物に溶解し、0°Cに冷却した。
RuCl・3 H2O(0.12 mmol)およびNaIO4(400 mg、1.87 mmol)を水(5 mL)に溶解し、オレフィン溶液に一気に加えた。 15秒撹拌した後、チオ硫酸ナトリウム50%水溶液(15 mL)で反応停止しました。抽出し精製処理を行い目的物を87%で得た。
なぜか溶媒はMeCN、AcOEt、水の3溶媒系で実施している例が多いです。反応は非常に短時間(<5min)で終了します。
ウッドワード反応(ウッドワードシスヒドロキシ化、Woodword-Prevost reaction)
ヨウ素と酢酸銀を作用させて生じるシスジオールモノ酢酸エステルを塩基によって脱保護するとシスジオールを合成できます。
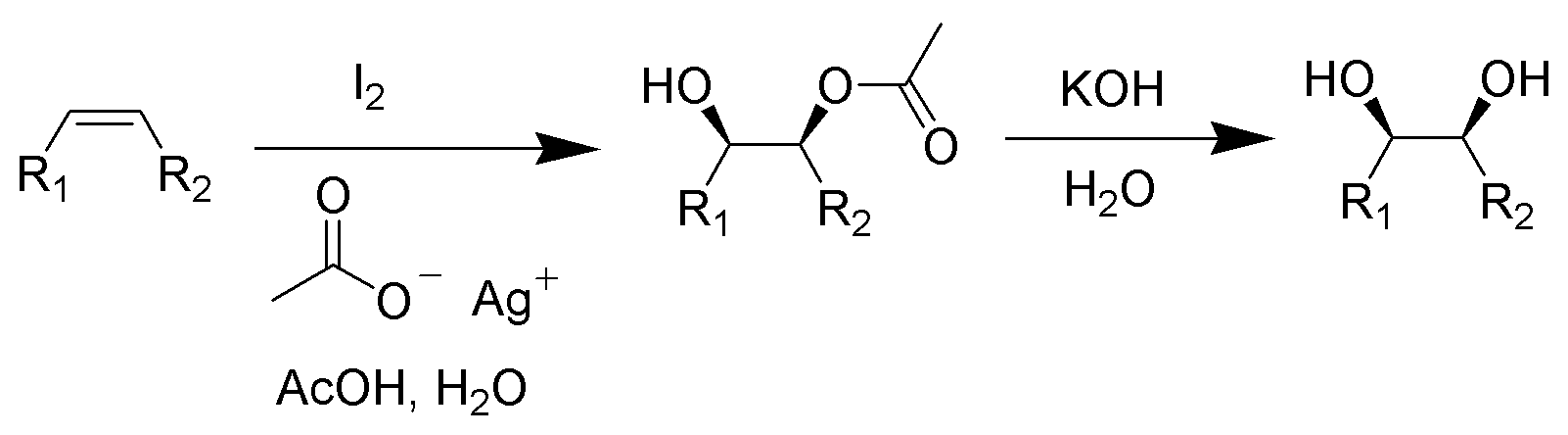
from wikipedia public domain
酢酸銀よりも安価なヨウ素酸カリウムを使っても反応が進行します。