アルドール反応とは?
アルドール反応はエノールとカルボニル化合物(ケトン、カルボニル)の反応です。有機合成では物質の骨格となる炭素をどんどんつなげて目的の分子をつくるため、炭素と炭素を結合するアルドール反応は重要で、最も有名な反応の一つです。
 こめやん
こめやん
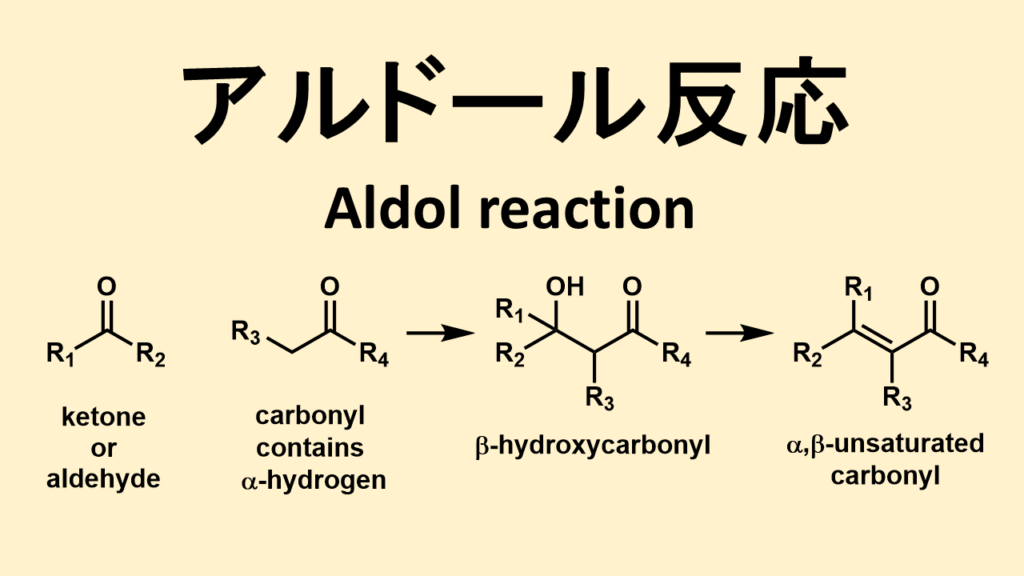
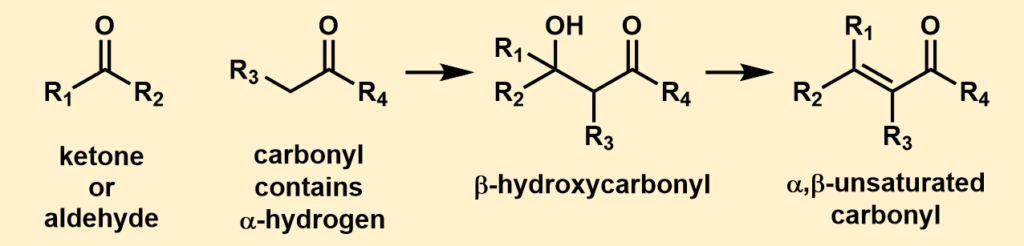 上の図がアルドール反応の概略図です。
上の図がアルドール反応の概略図です。
アルドール反応は、カルボニル化合物とエノールの反応と言いました。上の図で言えば、左から二番目の分子がエノールになる分子です。
 こめやん
こめやん
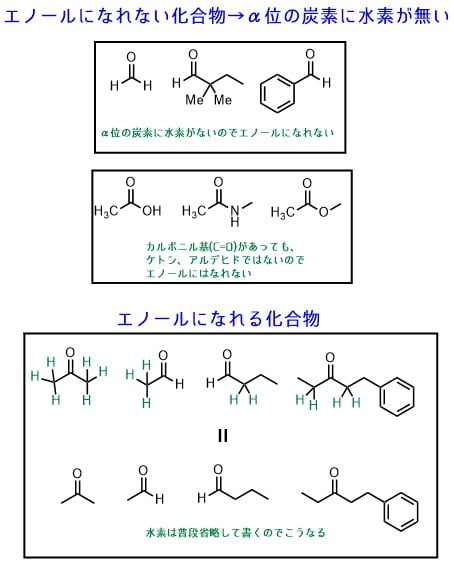
確かにエノールは、カルボニル化合物(ケトンやアルデヒド)から生成する化合物です。しかし、どんな化合物でもエノールになるわけではありません。エノールになれるのは、α水素を持っているカルボニル化合物です。
アルドール反応の原料 エノールとは?
エノールとはどんな化合物か?どうやって生成するのか?をご存知の方は読み飛ばしてください

エノールになれない化合物となれる化合物の違いを下の図に示しました。例えば、ホルムアルデヒドやベンズアルデヒドなどはα位の炭素に水素を持たないため、エノールになれません。また、カルボン酸、アミド、エステルなどもエノールになれません。
エノールになれるのは、アルデヒドやケトンのうち、α位の炭素に水素がある化合物だけです。
エノールの生成
カルボニル化合物のうち、α位の炭素に水素をもつ化合物は、エノール体を生成します。エノールの生成は、塩基性条件、酸性条件どちらでも起こります。
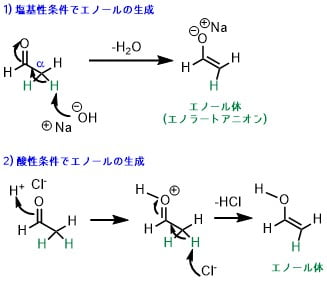
1) 塩基性条件では、水酸化ナトリウム (NaOH)などの塩基によって、α水素を引き抜くことから開始します。これによって二重結合が生成し、エノラートアニオンが生成します。エノラートアニオンは水からプロトンを引き抜けば、エノールになります。
2) 酸性条件では、塩化水素などの酸によって、カルボニル基がプロトン化することから始まります。プロトン化された後、α水素が脱離してエノールが生成します。
エノールの反応性
下の図のようにエノールは電子不足な化合物Zと反応して、α位の炭素に結合を形成します。エノールはα位に電子不足な化合物と結合する反応性を持っています。もしもZがプロトンならもとのカルボニルに戻ります。
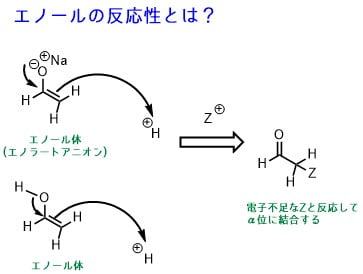
このZがカルボニル化合物だった場合、アルドール反応になります。
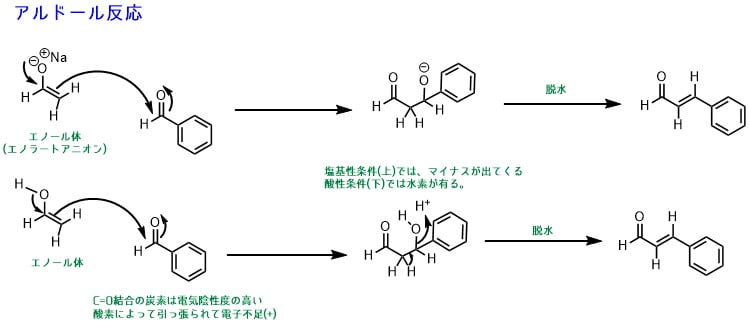
カルボニル化合物(ベンズアルデヒド)のカルボニル基は電気陰性度の高い酸素原子によって炭素が電子不足(+に分極)なので、エノールと反応します。
反応によって、カルボニル化合物がエノールのα位に結合します。アルドール反応はこれで終了することもありますが、そのまま水が取れて(脱水)、二重結合ができます。これはカルボニル基のα位とβ位の間に二重結合があるため、α,β-不飽和カルボニル化合物と呼びます。
ちなみにアルドール反応は、エノールを上の反応のように用意することもありますが、エノールの生成とカルボニルとの反応を同時にやってしまうことも多いです。(同時にやろうとすると、もしもどちらもエノール化可能なカルボニル化合物だった場合に問題が起こります。何が問題か考えてみると理解が深まるかもしれません。)
アルドール反応の概略
もう一度アルドール反応についてまとめると、
「α(アルファ)水素をもっているカルボニル化合物+アルデヒドあるいはケトンが反応してβ-ヒドロキシカルボニル化合物になる反応」
です。
一般的にはそのまま脱水反応が進行してα,β-不飽和カルボニル化合物まで変換されます。
この反応には触媒として酸、あるいは塩基が必要です。ちなみに典型的な例としてはアルデヒドおよびケトンを基質(反応するもの)として使い(ホモの場合もヘテロも)、触媒は塩基、できるものはα,β-不飽和カルボニルです。
エステル、アミド、カルボン酸辺りは反応性が低いのでアルデヒドやケトンと比べると使われません。
また、塩基触媒条件でエノラートにすることが多いと思います。できるものに関してもβ-ヒドロキシカルボニル化合物では止めずにそのまま縮合まで行ってしまうのが一般的かと思います。また、立体制御の観点から、α水素を持つカルボニル化合物をあらかじめエノラートにしておく方法も一般的です。反応するもの、できるものが多くて覚えにくいかもしれませんが、アルドール反応はそれぐらい応用力が高くて良い反応と言うことです。
| 反応名 | 反応するもの① | 反応するもの② | 触媒 | できるもの |
| アルドール | α水素を持つカルボニル (アルデヒド、ケトン、エステル、アミド、カルボン酸) | アルデヒド、ケトン | 酸および塩基 | β-ヒドロキシカルボニルおよびα,β-不飽和カルボニル |
アルドール反応の歴史
この変換反応の名前は、アセトアルデヒドの酸触媒による自己縮合生成物の3-ヒドロキシブタナールの慣用名であるアルドールに由来します。すなわち
Aldehyde(アルデヒド) + Alcohol(アルコール) = Aldol (アルドール)
こう考えると生成物がわかりやすいですね!ただ反応の出発物はアルコールではないのと、アルデヒドを使わなかった場合はβ-ヒドロキシアルデヒドにはならないので、そこは勘違いしないようにしましょう。
もともと、アルドール反応はブレンステッド酸、あるいはブレンステッド塩基触媒条件かで行われていましたが、このような条件では、自己縮合、ポリ縮合、脱水反応とそれに続くマイケル付加反応などの副反応が進行してしまいます。ですので最近ではルイス酸を使ったもの、不斉制御や有機分子触媒をつかったものなどがあります。そちらは人名反応として別の機会に紹介します。
反応機構
アルドール反応では、ブレンステッド酸触媒を用いた場合と、ブレンステッド塩基触媒を用いた場合の反応機構が異なります。ブレンステッド酸を用いたアルドール反応では、並行的に生成するエノールが求核剤として作用します。求電子剤中のカルボニル基は、プロトン化されることで活性化され、求核攻撃を受けやすくなっています。
塩基触媒を用いたアルドール反応では、脱プロトン化によってエノラートが生成し、続いてエノラートがカルボニル基に求核攻撃します。
酸を用いた場合も塩基を用いた場合でも、反応はいくつもの平衡反応を経て進行して、化合物の生成は可逆になります。
アルドール反応の立体選択性について
また、一般的にあらかじめ調整されたエノラートを用いる場合では、生成物が高いジアステレオ選択性で得られます。その場合、(Z)-エノラートを用いた場合はシン体が、(E)-エノラートを用いた場合はアンチ体が優先的に得られます。この立体選択性に関しては、アルドール反応が六員環いす形遷移状態を経て進行することから、Zimmerman-Traxlerモデルを用いて説明できます。環状遷移状態において1,3-ジアキシアル相互作用によって不安定化を避けるようにすることから立体が制御されると考えられています。
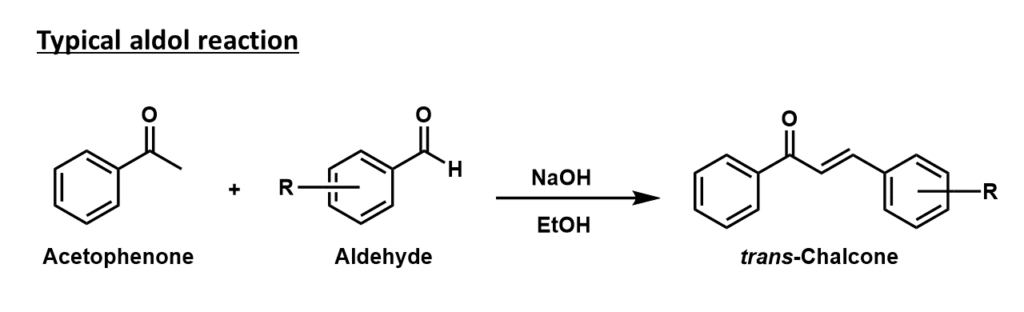
実験手順
Ethanol (10ml) に溶かしたacetophenone(1eq. 8.3mmol)をフラスコに入れ、攪拌中にaldehyde(1eq. 8.3mmol)、水酸化ナトリウム(0.1eq. 0.84mmol)をそれぞれ加えた。室温で5時間攪拌してTLCで反応の完了を確認した後、生じた白色沈殿をろ取した。得られた白色固体を再結晶して目的のtrans-Chalconeを得た。-Bioorganic Chemistry 82 (2019) 156–162
実験のコツ
- ブレンステッド酸およびブレンステッド塩基を用いたアルドール反応の場合、副生成物が多くなるため、試薬の投入はゆっくり行う。
- アルデヒド、特に脂肪族アルデヒドは不安定で自動酸化等で分解してしまう可能性があるので気を付ける。