TEMPO酸化は安定なニトロキシラジカルである2,2,6,6-テトラメチルピペリジン1-オキシフリーラジカル (TEMPO)を使った酸化方法です。
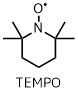
TEMPOの構造
TEMPOは主に第一級アルコールをアルデヒドに酸化するのに用いられます。
TEMPOとは 安定なフリーラジカルの仕組み
TEMPOは1960年にLebedevらによって発見されたニトロキシラジカルです。
ラジカルは通常不安定ですが、TEMPOはニトロキシラジカルのα位にある4つのメチル基による立体障害によってラジカルが遮蔽されているため安定です。
また、ラジカルがN-O間で非局在化しているため安定化しています。
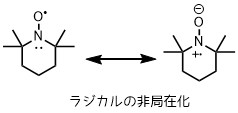
ラジカルの安定化
ラジカルは通常反応性が高いことから、安定に単離することが困難ですがラジカルを安定化させることもできます。ラジカルを安定化機構としては
- ラジカルの非局在化
- 立体障害
があります。
TEMPOが安定な理由は傘高さだけでなく、四級炭素のため、引き抜かれる水素がないのでラジカル移動が起こらない点もあります。
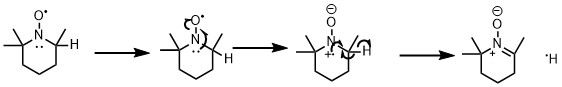
TEMPOが安定な理由
α水素があると水素ラジカルとして脱離する副反応などが起こります。TEMPOはα水素がないので安定です。
TEMPO酸化の反応機構
酸化活性種の生成メカニズム
酸化活性種はTEMPOの次亜塩素酸ナトリウムなどによる酸化によって生成します。
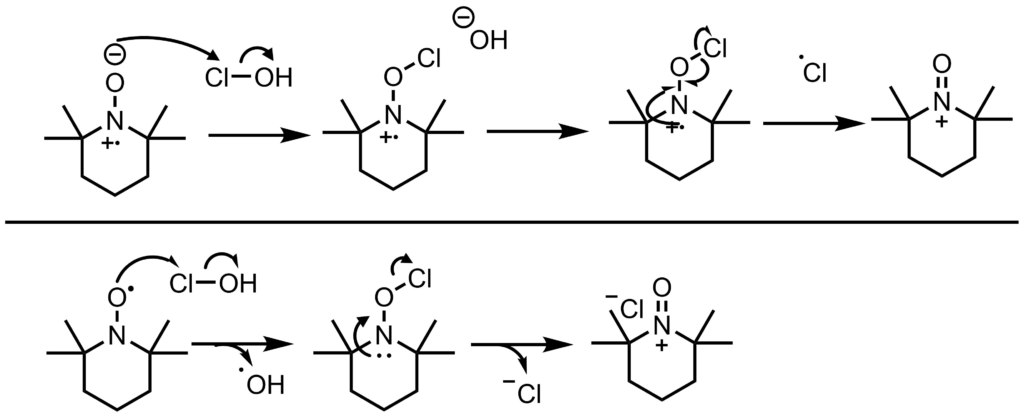
TEMPO酸化の活性中間体の推定生成機構
TEMPO酸化の特徴や条件
TEMPO酸化は第一級アルコールを選択的にアルデヒドに酸化できます。TEMPO酸化はマイルドな酸化方法であり、ラセミ化が起こりにくいのが特徴です。
TEMPO酸化は化学両論量的酸化と触媒的酸化も可能であり、条件もたくさんあります。最近は空気中の酸素を利用した酸化も報告されています。
TEMPOだけで酸化させるためには、オキソアンモニウム塩に酸化する必要があります。
化学両論量的に酸化を行う場合はすでに酸化されたTEMPOを用いて行います。塩のカウンターアニオンの種類によって酸化の選択性が変化し、塩化物イオンの場合は第一級アルコールの酸化が進行し、過塩素酸イオンの場合は第二級アルコールが優先的に酸化されます。この方法は複素環のアルデヒド合成に有用なようです。
基本的にはアルデヒド合成に利用!
ケトンへの酸化は遅く、条件によってはカルボン酸まで酸化可能!
触媒的酸化方法
TEMPOは共酸化剤として次亜塩素酸塩を用いることによって、1~5mol%程度のTEMPOの量でも酸化がスムーズに進行します。
第一級アルコールの酸化方法の基本の条件は、TEMPO 1mol%、ジクロロメタン、KBr(1.3eq), NaOCl(次亜塩素酸ナトリウム溶液 1.3eq相当)にアルコールを加えて酸化する方法です。この方法では第一級アルコールが選択的に酸化されます。
次亜塩素酸ナトリウムは軽量のしにくさがあり、水が加わることもあり、有機溶媒だけで反応できるBAIB(ヨビスアセトキシヨードベンゼン)を用いる方法も有用です。この方法では二級アルコールの酸化も進行しますが、遅いので第一級アルコール選択的な酸化が可能です。
他にはNXS、オキソン、mCPBA、t-BuOClなどが使われます。
二層系の時は第四級アンモニウム塩としてTBABなどを加えることが多いです。
反応条件
酸素を利用した方法
酸化剤として空気中の酸素を利用する方法は重金属や危険性のある試薬を使わないのでグリーンケミストリーの観点からも有用であり理想的な酸化方法として注目されています。
酸素を加圧もしくは常圧下で利用するものから解放系で空気中の酸素を利用する方法も報告されています。現状では触媒として鉄、銅塩などを用いることが多いようです。
酸素の例

Ryland, Bradford L. et al Journal of the American Chemical Society, 136(34), 12166-12173; 2014
0.2 mLのアルコールを2 mLの無水MeCNに0.01 mmolの[Cu(MeCN)4] OTf、0.01 mmolの2,2′-ビピリジル、0.01 mmol TEMPO、および0.02 mmolのN-メチルイミダゾールと混ぜました。O2バルーンを取り付けて攪拌しました。反応後濃縮、精製処理を行い目的物を99%で得た。
酸素酸化では銅触媒や鉄触媒を加えてやることが多く、ヨウ化銅、テトラキス(アセトニトリル)銅(I)トリフルオロメタンスルホナートは効率な金属触媒として有用であることが報告されています。また、リガンドとしてビピリジンを加えることが多いです。ほかの金属には硝酸鉄(III)や塩化鉄(III)を使います。
次亜塩素酸ナトリウムの方法
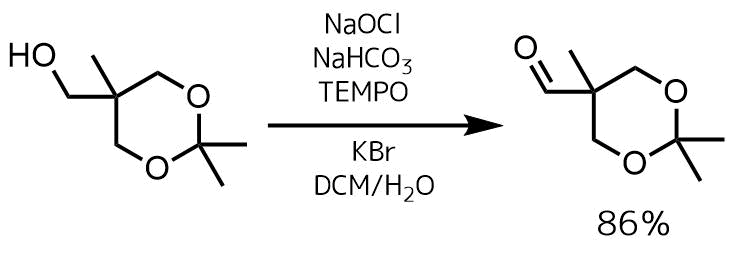
Trost, Barry M. et al Journal of the American Chemical Society, 136(1), 88-91; 2014
NaClO(1.6 M、17.5 mL、28.4 mmol)、炭酸水素ナトリウム(0.553 g、6.55 mmol)の溶液にアルコール体( 3.50 g、21.85 mmol)、TEMPO(34.4 mg、0.218 mmol)、および臭化カリウム(0.322 g、2.18 mmol)、水(1.82 mL)、ジクロロメタン(19.6 mL)を室温で加えて20分撹拌した。その後、NaClO(10 mL)を追加し、さらに15分間撹拌した。抽出、精製処理を行い目的物を86%で得た。
最も基本的な反応条件が次亜塩素酸ナトリウムを用いた酸化です。中性~弱塩基性条件で酸化が行われることが多く、リン酸バッファー中(pH7.8-8.6)で行うことも多いです。弱塩基性条件のほうが酸化力が高い傾向があり、ケトン体を合成するときは弱塩基性条件で行われることが多いですi)。アルデヒドがまず先に酸化され、続いてケトン体まで酸化します。第二級アルコールを酸化したい場合は、弱塩基性条件(pH=8.6), KBrを加えて、次亜塩素酸ナトリウムを過剰量加えるとよいです。第一級アルコールは相間移動触媒を加えるとカルボン酸まで酸化することも可能です。
i)T. Inokuchi, S. Matsumoto, T. Nishiyama, S. Torii, ibid . , 55, 462 (1990)
次亜塩素酸ナトリウム五水和物を用いた方法
次亜塩素酸ナトリウム水溶液は不安定で経年劣化して分解しやすく、炭酸水素ナトリウムやバッファーを使ってpHを8~9程度に調整しなければならないのが欠点です。一方で、次亜塩素酸ナトリウム五水和物は固体で秤量しやすいのが特徴です。
特に水溶液よりも水和物のほうが第二級アルコールの酸化に適しています(硫酸水素テトラブチルアンモニウムの添加が必要)。
Typical procedure:NaOCl・5H2O(2.0 g、12.2 mmol)Bu2NHSO4(0.17 g、0.50 mmol)、TEMPO(21 mg、0.13 mmol)、アルコール体(1.30 g、10.0 mmol)CH2Cl2( 5 mL~10 mL)。 Na2SO3飽和溶液でクエンチして抽出、目的物を得る。1) Kirihara, Masayuki, et al. “Sodium Hypochlorite Pentahydrate Crystals (NaOCl· 5H2O): A Convenient and Environmentally Benign Oxidant for Organic Synthesis.” Organic Process Research & Development 21.12 (2017): 1925-1937.
ジアセトキシヨードベンゼンを用いた方法
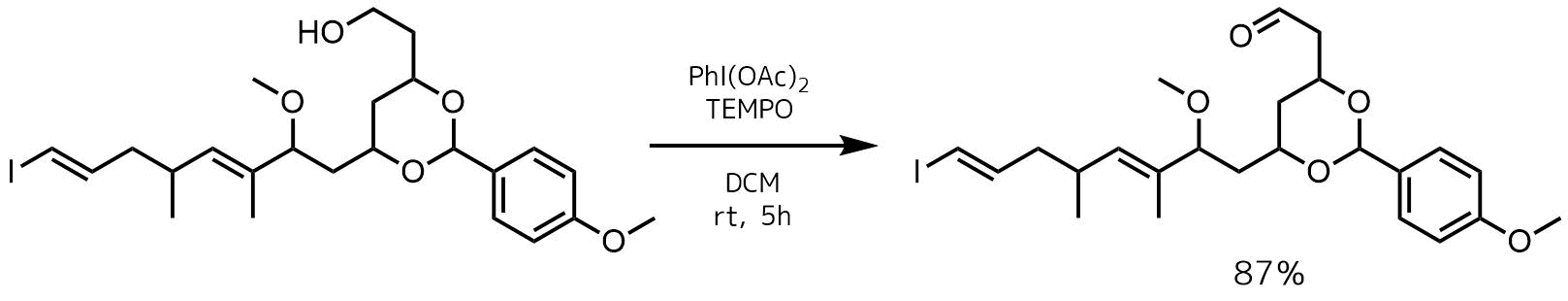
Tanabe, Yurika et al Organic Letters, 16(11), 2858-2861; 2014
アルコール体(15.3 mg、28.8μmol)のCH2Cl2(0.3 mL)の撹拌溶液に室温でジアセトキシヨードベンゼン(17.2 mg、53.4μmol)、TEMPO(1.0 mg、6.4μmol)を加えて室温で5時間撹拌し、反応後、飽和チオ硫酸ナトリウム水溶液(3 mL)で希釈し、抽出、カラム精製により目的物を87%で得た。
ジアセトキシヨードベンゼンを用いた方法は水を加えず、有機溶媒中で進行し、特に異性化しやすい二重結合などをもつ化合物に対して有効なようです。カルボン酸への過剰酸化も起こりにくいという報告があります。
De Mico, Antonella, et al. “A versatile and highly selective hypervalent iodine (III)/2, 2, 6, 6-tetramethyl-1-piperidinyloxyl-mediated oxidation of alcohols to carbonyl compounds.” The Journal of Organic Chemistry 62.20 (1997): 6974-6977.