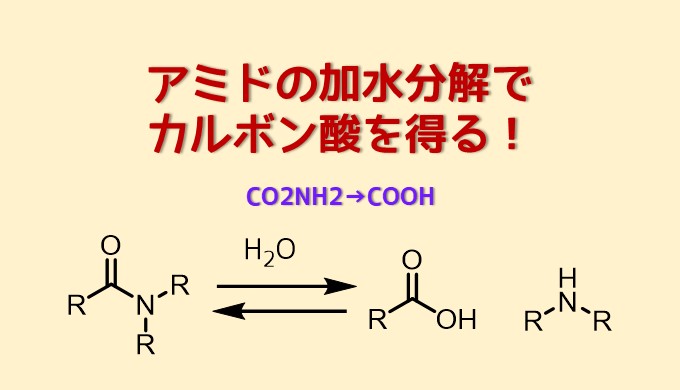
酸アミドを加水分解するとカルボン酸が得られます。アミドはカルボン酸誘導体のなかでは安定性が高く、加水分解は一般的にエステルよりも厳しい条件が必要です。
ここではアミドの加水分解によってカルボン酸を合成する方法について紹介します。
アミドは加水分解に強い
エステルとは異なり、アミドの加水分解は酸性条件で行います。
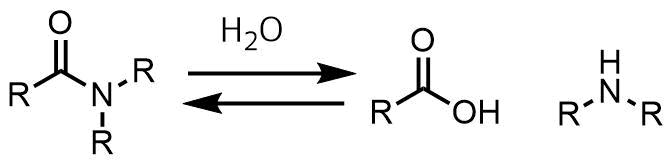
アミドの加水分解概要
塩基性条件で進行しにくいのはエステルでは脱離基がアルコキシドに対して、アミドではより不安定な金属アミドが生成することになるからです。
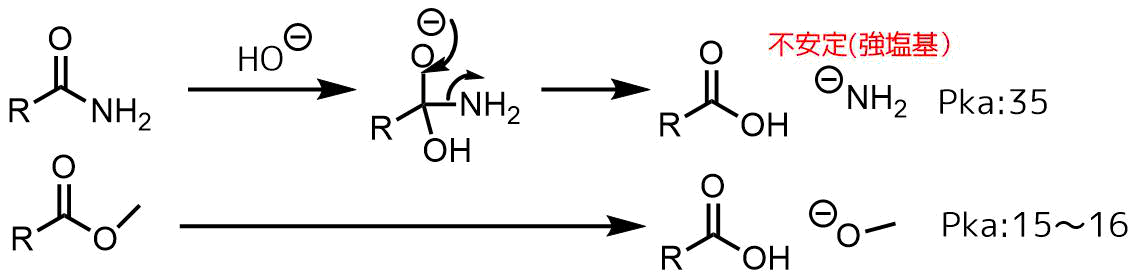
金属アミドが生成する機構
アミドの塩基加水分解で生成する金属アミド(NH2-)は非常に強い塩基であり、とても不安定なアニオンなので、生成しにくいです。したがって、アミドは酸加水分解条件で進行させます。
アミドの酸加水分解反応機構
アミドは酸加水分解が適しています。塩基性条件の時の金属アミド比べて中性のアミンの脱離のほうが有利です。
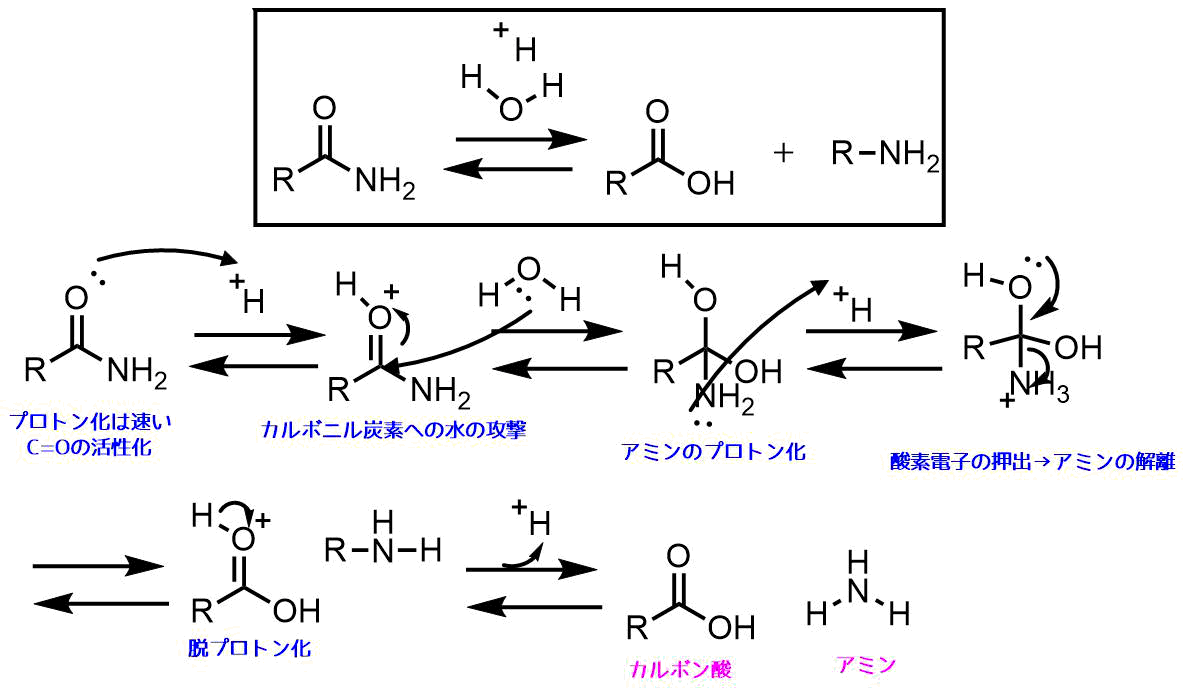
アミドの酸加水分解機構 生成するアミンは酸によって中和されて塩になる。
アミド加水分解の条件
アミドは加水分解の条件は主に酸性条件でHClやHBrなどの強酸を還流などの厳しい条件が必要です。
化合物がある程度溶解性がある場合は濃塩酸や濃臭化水素酸を加えて還流します。溶けない場合は、臭化水素-酢酸溶液を使うこともあります。当然酸に弱い官能基がある場合は使えません。
アルカリ加水分解も不利とは言え、カルボン酸塩の生成によってほぼ不可逆のため進行します。
反応例1 HCl

Che, Chao et al Journal of Combinatorial Chemistry, 9(6), 982-989; 2007
アミド(470 mg、2 mmol)を10%HCl(10 mL)に溶解し、混合物を4時間還流した。室温に冷却し戻した後、固体を濾過し、水(2 x 5 mL)で洗浄して、82%で得た。
一般的な酸加水分解の条件です。もう少し酸を濃くして濃塩酸を用いる場合もあります。また臭化水素酸を使う場合もあります。塩酸は揮発性の酸であるため、長時間反応させると揮発して濃度が薄くなることもあるので、その場合は濃塩酸を追加します。
反応例2 H3PO4
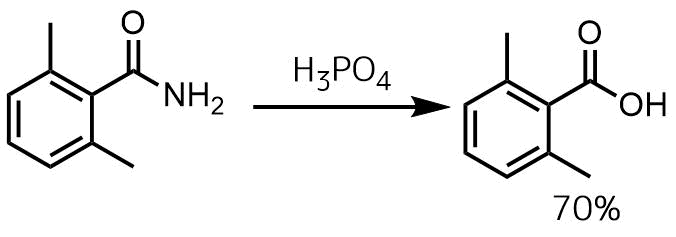
Moureu, Henri et al Compt. rend., 223, 951-2; 1946
アミドをリン酸で加熱して加水分解する方法です。リン酸は立体障害の大きいアミドの加水分解に有効です。
立体障害等で加水分解困難なアミド
アミドもエステルと同様に傘高いアミドやラクタムなどは加水分解にかなり耐えます。
加水分解困難なアミドの加水分解では濃リン酸を使って150℃くらいで加熱する条件が便利です。オルト二置換のカルボン酸アミドなどの傘高いアミドを加水分解できます。
ニトロソ化により加水分解する
加水分解が難しいアミド類はアミドの窒素をニトロソ化することによって加水分解しやすくする方法がとられることもあります。
ニトロソ化は亜硝酸ナトリウムや塩化ニトロシル、亜硝酸ブチルなどを用いて行います。
亜硝酸ブチルによる加水分解
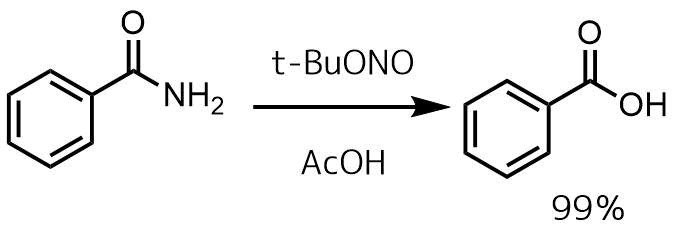
Chaudhary, Priyanka et al Green Chemistry, 18(8), 2323-2330; 2016
窒素雰囲気下で酢酸(3 ml)アミド(1 mmol)の攪拌溶液に、亜硝酸tert-ブチル(3当量)をゆっくりと加えます。反応混合物を75℃で60分間攪拌し、濃縮して酢酸を除去し、クルードに10%NaOHに溶解した後、酸性に戻して抽出、濃縮して目的物を99%で得る。
ニトロソ化によってカルボン酸に変換している例です。
亜硝酸ナトリウムによるニトロソ化→加水分解

Sattelkau, Tim et al Synthesis, (2), 262-266; 2001
アミド(63.2 mmol)をAcOH(70mL)とAc2O(400mL)の混合物に溶解し0℃でNaNO2(100.0 g)を3時間かけて少しずつ加えた後、氷冷しながらオーバーナイトした。生成した固体をろ過、無水酢酸、エーテルで洗浄し、ろ液を45℃以下に温めながら濃縮した。クルードをジクロロメタン(400 mL)に溶解し、洗浄液が塩基性を示すまで2 N NaOHで洗浄した。水層を再度ジクロロメタンで抽出、有機層を集めて濃縮、真空乾燥してニトロソ体を得た。これををEt2O(200 mL)とEtOH(20 mL)の混合物に溶解し、DIAZALDを用いて発生させたジアゾメタンで処理した後、エタノールを加えてエチルエステル体に変換し、これを加水分解してカルボン酸を89%の収率で得た。
ニトロソ化していますが手順が複雑です。傘高いアミドでも加水分解が高収率で得られています。