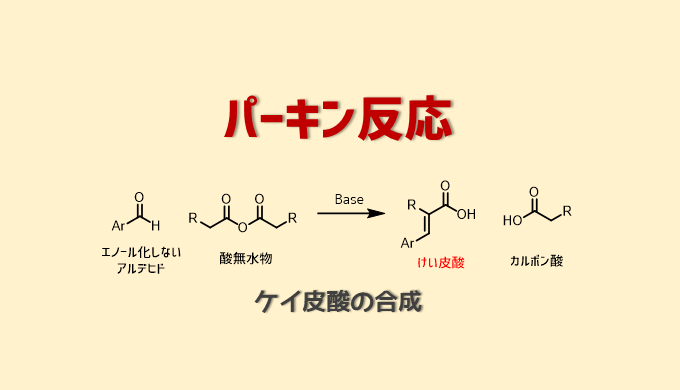
パーキン反応
パーキン反応は合成染料で功績を上げたウィリアム・パーキンが開発したけい皮酸を合成する反応です。
原料はエノール化しない芳香族アルデヒドと酸無水物を塩基性条件下で反応させます。
パーキン反応ではE体が優先して得られます。芳香環アルデヒドの4位に電子供与基があると反応性が低下します。アルデヒド近傍の立体障害によっても反応性は低下し、2,6位にメチル基があると反応は進行しない。
反応機構
反応機構は塩基によってα位の水素が引き抜かれて発生したエノールと芳香族アルデヒドがアルドール縮合を起こしてけい皮酸が合成されます。以下は推定の反応機構です。
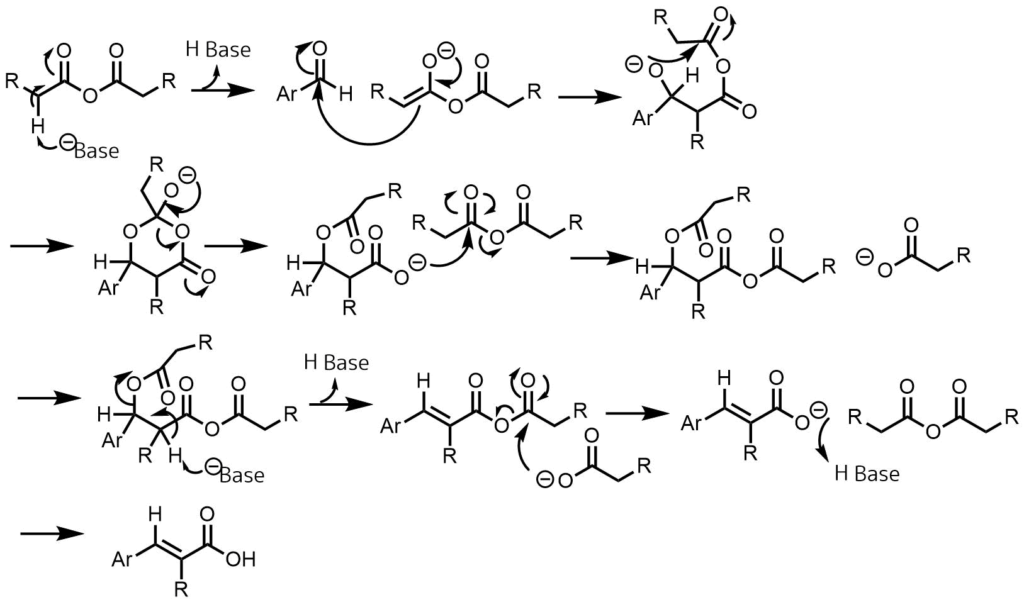
パーキン反応の反応機構 酸無水物からエノラートが生成、エノラートがアルデヒドに求核付加、生じたアルコキシドが分子内でカルボニル基に求核付加、カルボキシラートが生成し、酸無水物と反応、カルボキシラートが脱離するように酸性度の高めの水素を引き抜き二重結合が生成、酸無水物が分解してけい皮酸が生成する。
パーキン反応の応用
芳香族アルデヒドとしてサリチルアルデヒドを用いた場合分子内環化が起こりクマリンが生成する。
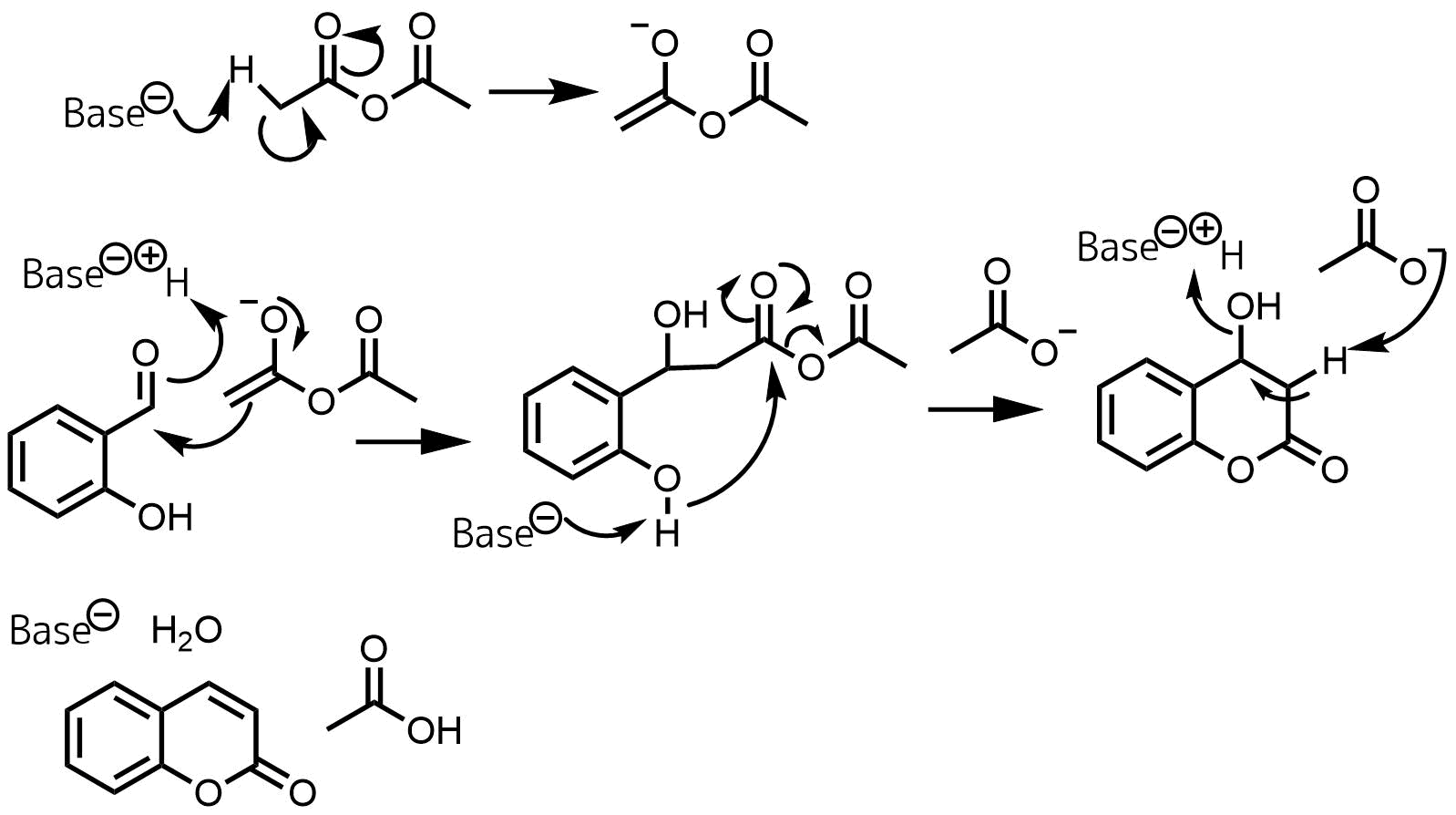
パーキン反応 クマリン合成
酸無水物の種類を変えれば3位に構造を変えることができますね。クマリンはワルファリンのような抗凝固薬の母核として用いられたり、蛍光色素の母核として用いられています。
参考文献
- Krisztián Csankó, PhD Dissertation: “Stereoselective synthesis and self-assembling capabilities of heterocyclic cinnamic acids” 2015
Conference: PhD Defense at the University of SzegedAt: Szeged, Hungary. - https://en.wikipedia.org/wiki/Perkin_reaction
- Rabbani, G. “A Concise Introduction of Perkin Reaction.” Org. Chem.: Curr. Res 7.2.10 (2018): 4172.
- https://www.sciencedirect.com/topics/chemistry/perkin-reaction


パーキン反応の機構に誤りがあるような気がするので首を突っ込ませていただきます。
酸無水物のα位の水素は酸性度が高いことが知られているので、AcONaのような弱塩基でもプロトンが引き抜かれてエノラートが発生します。よって、フェノールが無水酢酸に攻撃するのではなく、無水酢酸がフェノキシドもしくは塩基によって脱プロトン化を受けることでエノラートが生じ、そのエノラートがアルデヒド側に入った後に分子内環化、脱アセトキシ化することでクマリンができる機構が正しいと思います。
酸無水物のα水素が引き抜かれてエノラートが生成というのが正しいですね。
ありがとうございます。修正します