前回は分子の構造について紹介しました。今回は、化学の基本である酸と塩基の話です!
酸というとどんなことをイメージしますか?
酸っぱいとか溶けるとか、危険なイメージも多いと思います。
塩基と比べて、酸は身の回りにたくさんあるので、イメージしやすいかもしれません。
酸の正体についてみていきます。
酸の正体とは?
酸の正体を探るにはまず、酸と言われているものの情報を集めてみましょう。
酸性の化学物質は○○酸という名前がついていることが多いので挙げやすいと思います。
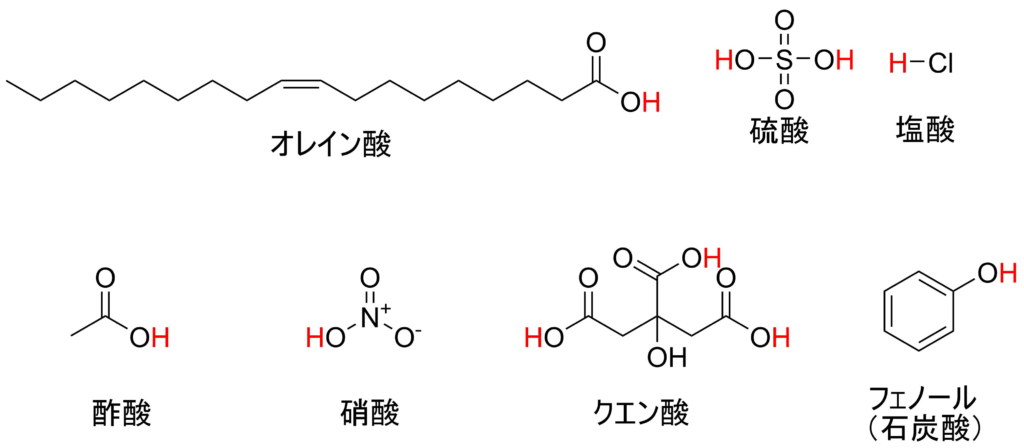
よくよく酸性の物質を眺めると共通の形があることに気づきます。酢酸の構造に似た部分が多くあります。この構造を持つ種類のことを「カルボン酸」と呼びます。また、酸素の数が多いということも気づくのではないでしょうか。
酸には、この酸素と水素の関係が重要です。
水は同じように酸素と水素がつながっていますが、一つの酸素であればそこまで電子を奪われるわけではないです。
しかし、酢酸のようにカルボン酸は2つの酸素があるために、水素も耐えられず電子を渡してしまいます。2つある酸素はお互いに、電子を受け渡しを繰り返します。これを共鳴とよんだりします。受け渡しのパターンが多いほど、酸性は強くなります。例えば、硫酸はカルボン酸と比べて酸素が4つの倍です。これに伴い、受け渡しのパターン数も増えます。だから、硫酸は強い酸の代表例なのです。
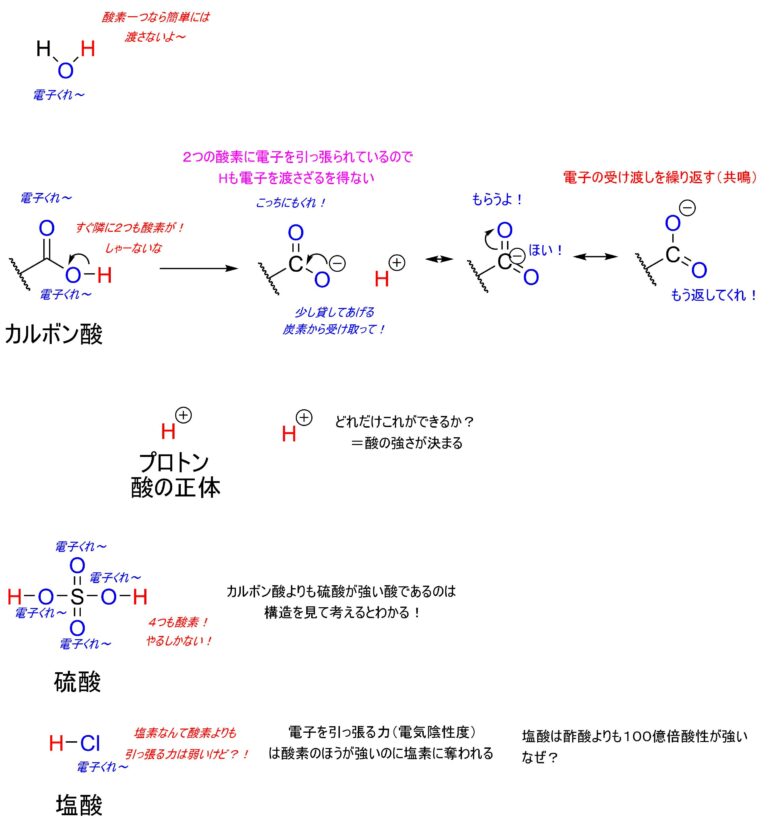
酸の正体は電子を渡した水素カチオン、プロトンが酸の正体です。これが生成しやすい=酸性度が高いということになります。ちなみに塩酸の塩素は酸素よりも電気陰性度が小さく引っ張る力が弱いのに、酸性はカルボン酸よりも100億倍もつよいです。一体なぜでしょうか。それは酸性度が引っ張る力だけで決まるわけではないからです。その話はまた今度します。
塩基の正体
塩基で有名なのは水酸化ナトリウムです。水酸化ナトリウムは電子を与えたがるナトリウムと電子を奪いたがる酸素(O)が結合したカタチをしています。お互いの要求が一致しているので、NaはOHに電子をあげて、お互いにイオンになります。感の良いひとは気づいたと思いますが、このOH-こそが塩基の正体です。
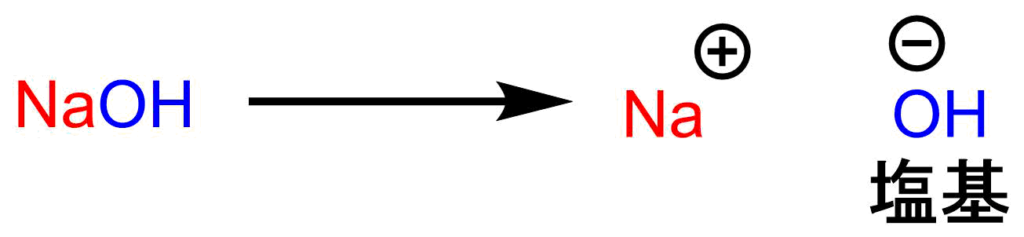
これまでの内容をまとめると
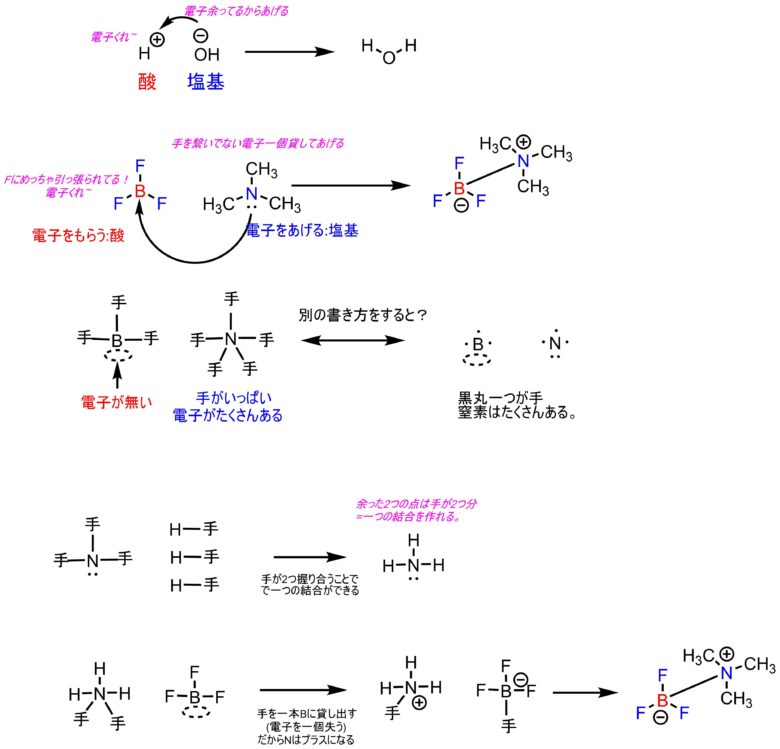
H+が酸。OH-が塩基だということがわかりました。
この2つの酸と塩基を反応させてみると性質が見えてきます。
電子をたくさん持っているマイナスの塩基は電子を与えたがる。
電子が不足しているプラスの酸は電子を奪いたがる
という性質です。
この性質に当てはまるものなら水素以外も酸に、OH-以外も塩基になると考えた人がいます。
たとえばBF3という化合物は水素がなくても酸です。上記の主張をした人の名前をとってルイス酸と呼びます。