アリールハライドはクロスカップリング反応の基質など多くの反応に利用できる原料として有用です。
本記事では芳香環に直接ハロゲンを導入する方法を紹介します。
目次
芳香環への直接臭素導入法
芳香環への直接的なハロゲン化は臭素や塩素を用いてハロゲン化が進行します。
直接的なハロゲン化は電子豊富な芳香環のほうが起こりやすく、ニトロ基やハロゲン、カルボキシ基を持つ電子不足な芳香環に対しては起こりにくいです。
塩素化は塩化スルフリルやNCS
臭素化はNBSが良く使われます。
臭素による臭素化
臭素はジクロロメタンやアセトニトリル、酢酸などの溶媒中攪拌するだけで臭素化できます。強力な臭素化試薬ですが、毒性が高く、液体で秤量も難しく精密な臭素化には向いていません。現在は臭素の代替として、NBSを用いることが多いです。
NBS、DBHを用いた臭素化
NBSは代表的な臭素化試薬で、1当量のNBSを適当な溶媒中で0℃~還流下撹拌するだけで臭素化できます。
ニトリルやニトロ基を含む電子不足な芳香環では酸を添加して臭素化します。一方でメトキシ、アミン、アルキルなどの置換基の多い電子豊富な芳香環の場合は溶媒だけで臭素化できます。
パラジウム触媒を用いて方法もあります。ニトリルのオルト位選択的な臭素化が達成されています。

Du, Bingnan et al Journal of Organic Chemistry, 78(6), 2786-2791; 2013
DBHはNBSと同様に臭素化に用いることができる試薬です。ジニトロベンゼンのような電子不足な芳香環に対しても臭素化できます。

Pandey, Sunil Kumar et al Organic Letters, 17(1), 122-125; 2015
ニトロ体 (20.5 g, 113 mmol) を濃 H2SO4 (80 mL) に溶解し、DBH (17.6 g, 60.8 mmol) を少しずつ分けて10分間かけて加えた。室温で1時間攪拌し、反応後氷水に注いで生じた固体をろ過、乾燥して目的物を100%で得た。
NaBrと過ヨウ素酸、硫酸を用いた臭素化も報告されています。アルデヒドも影響を受けずに臭素化可能です。
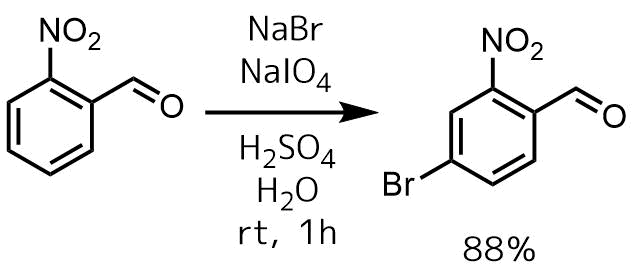
Cummings, Matthew M. and Soderberg, Bjorn C. G. Synthetic Communications, 44(7), 954-958; 2014
電子豊富な芳香環の臭素化
フェノールやアニリンなどの電子豊富な芳香環の臭素化は複数の臭素が入る副反応(ポリ臭素化)が起こる問題があります。アニリンではアミンをアシル基で保護して供与性を低下させたり、電子豊富な芳香環の臭素化によく利用される「ジオキサン・臭素付加体」を用いるなど種々の方法が開発されてきています。
酢酸アンモニウムを触媒量加えてNBSで臭素化を行う方法が簡便で早いので良いです。酢酸アンモニウムの添加で酢酸と臭化水素が生じてこれらが触媒として働くようです。
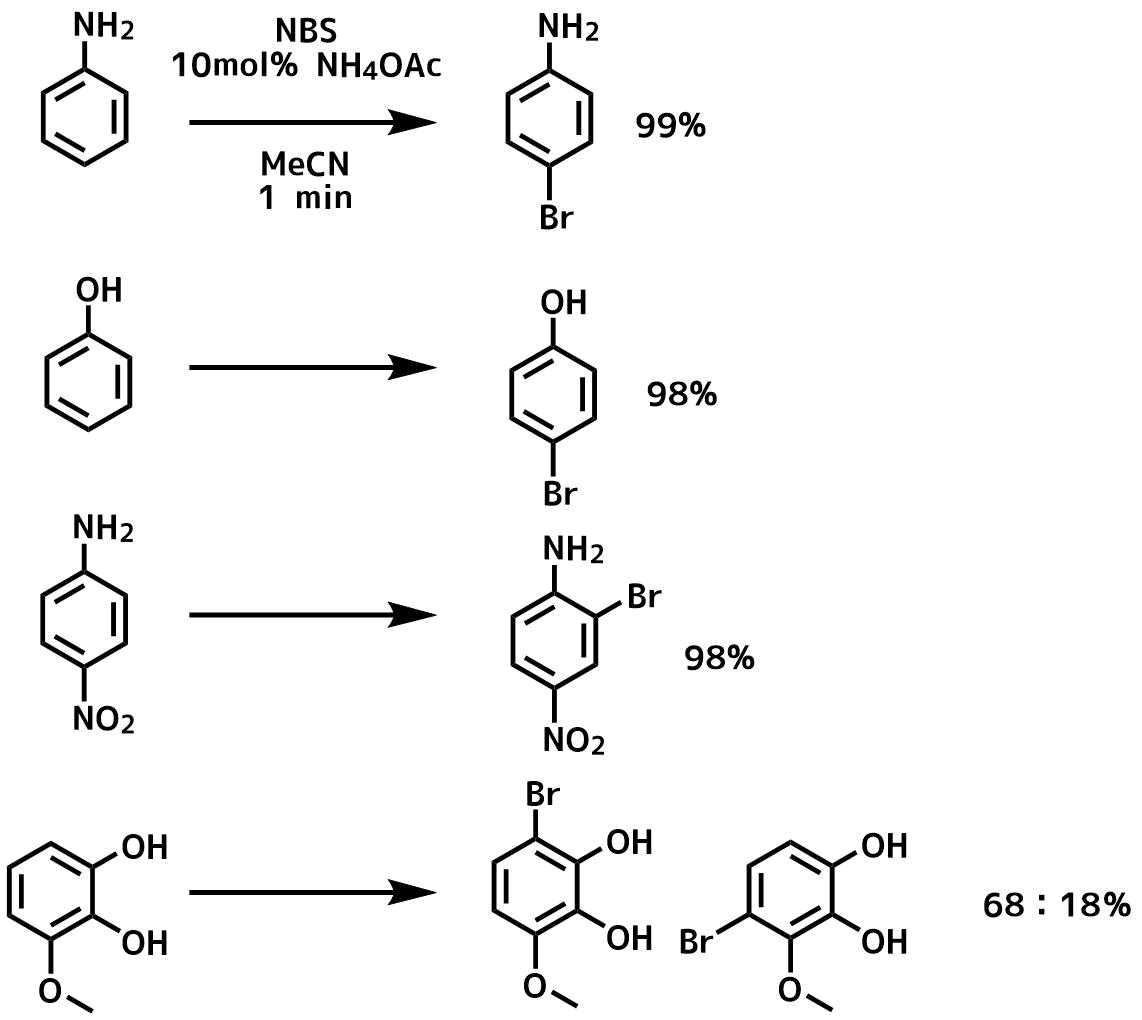
Das, Biswanath et al Journal of Molecular Catalysis A: Chemical, 267(1-2), 30-33; 2007
MeCN(5 ml)NBS(1.05 mmol)基質(1 mmol)およびNH4OAc(10 mol%)を室温で攪拌した。濃縮、分液後、カラム精製により目的物を得た。
パラ位の臭素化が進行しやすいですが、オルト位の臭素化が進行しやすい条件も報告されています。
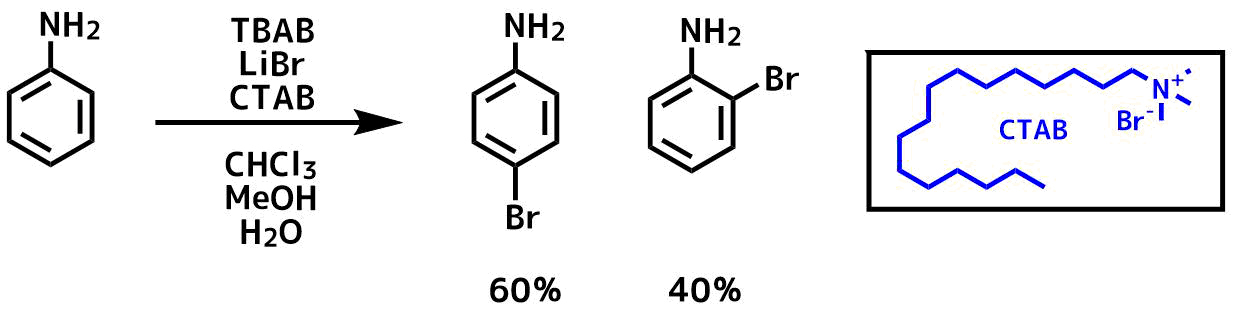
Cerichelli, Giorgio et al Tetrahedron Letters, 30(45), 6209-10; 1989
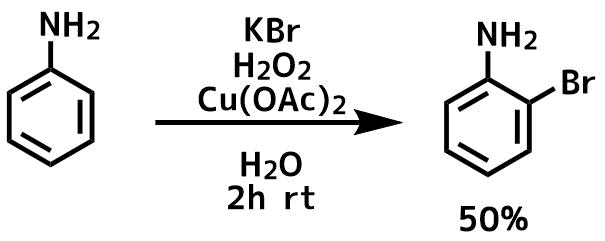
Zhu, Qing et al CN 106748809, 31 May 2017
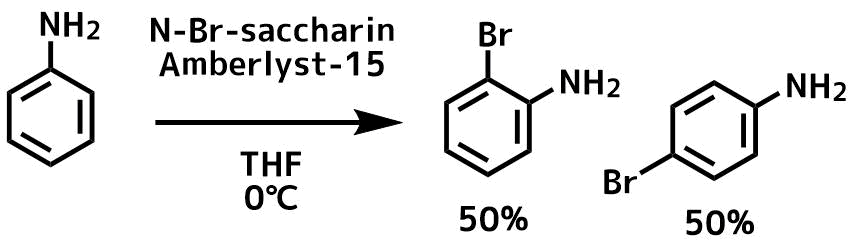
Baharfar, R. et al Journal of the Chilean Chemical Society, 56(4), 863-865; 2011
アニリンのメタ位の臭素化はニトロベンゼンの臭素化後に還元してアニリンにする方法で作ります。

その他の臭素化方法としては
HBr/AlCl3(Su, Binlin et al CN103012026, 03 Apr 2013), HBr/O2, H2O2, RuCl3, Cu(OAc)2…、TBA・Br3などが臭素化剤として利用されています。